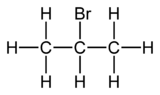
2-bromopropan

|
|||
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
2-bromopropan |
|||
| Inne nazwy Bromek izopropylu
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 741852 | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.000.778 | ||
| Numer WE |
|
||
| Siatka | 2-bromopropan | ||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
| UNII | |||
| Numer ONZ | 2344 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 3 H 7 Br | |||
| Masa cząsteczkowa | 122,993 g·mol -1 | ||
| Wygląd | Bezbarwna ciecz | ||
| Gęstość | 1,31 g ml -1 | ||
| Temperatura topnienia | −89,0 °C; −128,1 ° F; 184,2 tys | ||
| Temperatura wrzenia | 59 do 61°C; 138 do 142 ° F; 332 do 334 K | ||
| 3,2 g L -1 (przy 20 ° C) | |||
| dziennik P | 2.136 | ||
| Ciśnienie pary | 32 kPa (przy 20 °C) | ||
|
Stała prawa Henry'ego
( k H ) |
1,0 μmol Pa -1 mol -1 | ||
|
Współczynnik załamania światła ( n D )
|
1.4251 | ||
| Lepkość | 0,4894 mPa-s (przy 20 ° C) | ||
| Termochemia | |||
|
Pojemność cieplna ( C )
|
135,6 JK mol -1 | ||
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−129 kJ mol −1 | ||
|
Standardowa entalpia spalania (Δ c H ⦵ 298 ) |
−2,0537–−2,0501 MJ mol −1 | ||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
 
|
|||
| Niebezpieczeństwo | |||
| H225 , H360 , H373 | |||
| P210 , P308+P313 | |||
| NFPA 704 (ognisty diament) | |||
| Punkt zapłonu | 19 ° C (66 ° F; 292 K) | ||
| Związki pokrewne | |||
|
Powiązane alkany
|
|||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
2-Bromopropan , znany również jako bromek izopropylu i bromek 2-propylu , jest fluorowcowanym węglowodorem o wzorze CH3CHBrCH3 . Jest to bezbarwna ciecz. Służy do wprowadzania izopropylowej grupy funkcyjnej w syntezie organicznej . 2-Bromopropan otrzymuje się przez ogrzewanie izopropanolu z kwasem bromowodorowym .
Przygotowanie
2-bromopropan jest dostępny w handlu. Można go wytworzyć w zwykły sposób z bromków alkilowych, w reakcji izopropanolu z fosforem i bromem lub z trójbromkiem fosforu .
Bezpieczeństwo
Krótkołańcuchowe halogenki alkilowe są często rakotwórcze .
bromu znajduje się w pozycji drugorzędnej, co umożliwia cząsteczce łatwą dehydrohalogenację z wytworzeniem propenu , który ucieka jako gaz i może rozerwać zamknięte naczynia reakcyjne. Gdy odczynnik ten jest używany w reakcjach katalizowanych zasadą, zamiast wodorotlenku sodu lub potasu należy stosować węglan potasu .
Dalsza lektura
- Max Gergel , „Przepraszam pana, czy chciałby pan kupić kilogram bromku izopropylu?” Pierce Chemical Co. (1979). (historia start-upu firmy chemicznej).


