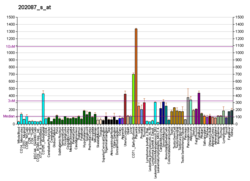
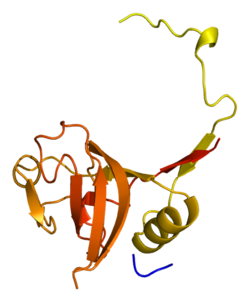
Katepsyna L1
| CTSL | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , CATL, CTSL1, MEP, katepsyna L | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Katepsyna L1 jest białkiem , które u ludzi jest kodowane przez gen CTSL1 . Białko to jest katepsyną cysteinową , lizosomalną proteazą cysteinową , która odgrywa główną rolę w wewnątrzkomórkowym katabolizmie białek .
Funkcjonować
Katepsyna L1 należy do rodziny MEROPS peptydazy C1 ( katepsyny ) , która odgrywa ważną rolę w różnych procesach, w tym w prawidłowym obrocie białek za pośrednictwem lizosomów, przetwarzaniu antygenu i probiałka oraz apoptozie. Jego substratami są kolagen i elastyna , a także inhibitor proteazy alfa-1 , główny element kontrolujący aktywność elastazy neutrofili . Kodowane białko bierze udział w kilku procesach patologicznych, w tym miofibryli w miopatiach i niedokrwieniu mięśnia sercowego oraz w odpowiedzi kanalików nerkowych na białkomocz . Białko to, które należy do rodziny peptydaz C1, jest dimerem składającym się z łańcuchów ciężkich i lekkich połączonych wiązaniami dwusiarczkowymi , wytwarzanych z pojedynczego prekursora białka. Dla tego genu znaleziono co najmniej dwa warianty transkryptu kodujące to samo białko.
Wpis wirusowy
Rozszczepienie białka kolczastego SARS-CoV-2 S2 wymaganego do wejścia wirusa do komórek można przeprowadzić za pomocą proteaz TMPRSS2 znajdujących się na błonie komórkowej lub katepsyn (głównie katepsyny L) w endolizosomach . Hydroksychlorochina hamuje działanie katepsyny L w endolizosomach, ale ponieważ rozszczepienie katepsyny L jest niewielkie w porównaniu z rozszczepieniem TMPRSS2, hydroksychlorochina w niewielkim stopniu hamuje infekcję SARS-CoV-2.
Zapalenie
Chociaż katepsyna L jest zwykle charakteryzowana jako proteaza lizosomalna, może być wydzielana, co prowadzi do patologicznego stanu zapalnego . Katepsyna L i inne katepsyny cysteinowe są zwykle wydzielane przez makrofagi i inne atakujące tkanki komórki odpornościowe, gdy powodują patologiczny stan zapalny.
Interakcje
Wykazano, że CTSL1 oddziałuje z Cystatyną A.
Dystrybucja
Katepsynę L opisano w wielu organizmach, w tym u ryb, ptaków, ssaków i gąbek.
Zobacz też
- Katepsyna L2 (znana również jako katepsyna V)
Dalsza lektura
- Smith CG, Smith MT, Besch NF i in. (1980). „Wpływ delta 9-tetrahydrokanabinolu (THC) na funkcje rozrodcze kobiet”. Postępy w naukach biologicznych . 22-23: 449-67. doi : 10.1016/b978-0-08-023759-6.50040-8 . ISBN 9780080237596 . PMID 116880 .
- Goretzki L, Schmitt M, Mann K i in. (1992). „Skuteczna aktywacja postaci proenzymu aktywatora plazminogenu typu urokinazy (pro-uPA) przez proteazę cysteinową katepsynę L.”. FEBS Lett . 297 (1–2): 112–8. doi : 10.1016/0014-5793(92)80339-I . PMID 1551416 . S2CID 45421148 .
- Dunn AD, Crutchfield HE, Dunn JT (1991). „Przetwarzanie tyreoglobuliny przez proteazy tarczycy. Główne miejsca rozszczepienia przez katepsyny B, D i L”. J. Biol. chemia . 266 (30): 20198–204. doi : 10.1016/S0021-9258(18)54909-7 . PMID 1939080 .
- Stearns NA, Dong JM, Pan JX i in. (1991). „Porównanie katepsyny L syntetyzowanej przez normalne i transformowane komórki na poziomie genu, wiadomości, białka i oligosacharydu”. Łuk. Biochem. Biofiza . 283 (2): 447–57. doi : 10.1016/0003-9861(90)90666-M . PMID 2275556 .
- Ritonja A, Popović T, Kotnik M i in. (1988). „Sekwencje aminokwasowe ludzkich katepsyn nerkowych H i L”. FEBS Lett . 228 (2): 341–5. doi : 10.1016/0014-5793(88)80028-0 . PMID 3342889 . S2CID 45768546 .
- Gal S, Gottesman MM (1988). „Izolacja i sekwencja cDNA dla ludzkiej pro-(katepsyny L)” . Biochem. J. _ 253 (1): 303-6. doi : 10.1042/bj2530303 . PMC 1149292 . PMID 3421948 .
- Johnson DA, Barrett AJ, Mason RW (1986). „Katepsyna L inaktywuje inhibitor alfa 1-proteinazy przez rozszczepienie w regionie miejsca reaktywnego” . J. Biol. chemia . 261 (31): 14748–51. doi : 10.1016/S0021-9258(18)66935-2 . PMID 3490478 .
- Mason RW, Walker JE, Northrop FD (1987). „N-końcowe sekwencje aminokwasowe łańcuchów ciężkich i lekkich ludzkiej katepsyny L. Związek z klonem cDNA dla głównej proteinazy cysteinowej z mysiej linii komórkowej makrofagów” . Biochem. J. _ 240 (2): 373–7. doi : 10.1042/bj2400373 . PMC 1147428 . PMID 3545185 .
- Joseph L, Lapid S, Sukhatme V (1987). „Głównym białkiem indukowanym ras w komórkach NIH3T3 jest katepsyna L”. Kwasy nukleinowe Res . 15 (7): 3186. doi : 10.1093/nar/15.7.3186 . PMC 340927 . PMID 3550705 .
- Kärgel HJ, Dettmer R, Etzold G i in. (1982). „Działanie katepsyny L wątroby szczura na glukagon”. Acta Biol. Med. Ger . 40 (9): 1139–43. PMID 7340337 .
- Bevec T, Stoka V, Pungercic G i in. (1996). „Niezmienny fragment łańcucha p41 związany z głównym kompleksem zgodności tkankowej klasy II jest silnym inhibitorem lizosomalnej katepsyny L”. J. Exp. Med . 183 (4): 1331-8. doi : 10.1084/jem.183.4.1331 . PMC 2192513 . PMID 8666891 .
- Coulombe R, Grochulski P, Sivaraman J, et al. (1996). „Struktura ludzkiej prokathepsyny L ujawnia molekularne podstawy hamowania przez prosegment” . EMBO J. 15 (20): 5492–503. doi : 10.1002/j.1460-2075.1996.tb00934.x . PMC 452294 . PMID 8896443 .
- Baumgrass R, Williamson MK, Price PA (1997). „Identyfikacja fragmentów peptydów generowanych przez trawienie bydlęcej i ludzkiej osteokalcyny za pomocą lizosomalnych proteinaz katepsyny B, D, L, H i S”. J. Bone Miner. Rez . 12 (3): 447–55. doi : 10.1359/jbmr.1997.12.3.447 . PMID 9076588 . S2CID 20815411 .
- Fujishima A, Imai Y, Nomura T i in. (1997). „Struktura krystaliczna ludzkiej katepsyny L w kompleksie z E-64” . FEBS Lett . 407 (1): 47–50. doi : 10.1016/S0014-5793(97)00216-0 . PMID 9141479 . S2CID 46288832 .
- Ménard R, Carmona E, Takebe S i in. (1998). „Autokatalityczne przetwarzanie rekombinowanej ludzkiej prokatepsyny L. Wkład zdarzeń międzycząsteczkowych i jednocząsteczkowych w przetwarzanie prokatepsyny L in vitro” . J. Biol. chemia . 273 (8): 4478–84. doi : 10.1074/jbc.273.8.4478 . PMID 9468501 .
- Schick C, Pemberton PA, Shi GP i in. (1998). „Międzyklasowe hamowanie proteinaz cysteinowych katepsyn K, L i S przez antygen 1 raka płaskonabłonkowego serpiny: analiza kinetyczna”. Biochemia . 37 (15): 5258–66. doi : 10.1021/bi972521d . PMID 9548757 .
- Estrada S, Nycander M, Hill NJ i in. (1998). „Rola Gly-4 ludzkiej cystatyny A (stefin A) w wiązaniu docelowych proteinaz. Charakterystyka metodami kinetycznymi i równowagowymi oddziaływań mutantów cystatyny A Gly-4 z papainą, katepsyną B i katepsyną L”. Biochemia . 37 (20): 7551–60. doi : 10.1021/bi980026r . PMID 9585570 .
- Halfon S, Ford J, Foster J i in. (1998). „Leukocystatyna, nowa cystatyna klasy II wyrażana selektywnie przez komórki krwiotwórcze” . J. Biol. chemia . 273 (26): 16400-8. doi : 10.1074/jbc.273.26.16400 . PMID 9632704 .
Linki zewnętrzne
- MEROPS dotycząca peptydaz i ich inhibitorów : C01.032
- Katepsyna + L w US National Library of Medicine Medical Subject Headings (MeSH)