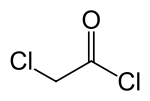
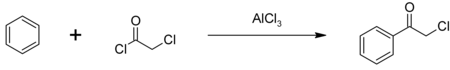Chlorek chloroacetylu
|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Chlorek chloroacetylu |
|
| Inne nazwy Chlorek 2-chloroacetylu Chlorek kwasu chlorooctowego Chlorek chlorooctu Chlorek monochloroacetylu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.001.065 |
| Numer WE |
|
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS |
|
| UNII | |
| Numer ONZ | 1752 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C2H2Cl2O _ _ _ _ _ _ | |
| Masa cząsteczkowa | 112,94 g·mol -1 |
| Wygląd | Bezbarwna do żółtej ciecz |
| Gęstość | 1,42 g/ml |
| Temperatura topnienia | -22 ° C (-8 ° F; 251 K) |
| Temperatura wrzenia | 106 ° C (223 ° F; 379 K) |
| Reaguje | |
| Ciśnienie pary | 19 mmHg (20°C) |
| Zagrożenia | |
| Oznakowanie GHS : | |
   
|
|
| Niebezpieczeństwo | |
| H301 , H311 , H314 , H331 , H372 , H400 | |
| P260 , P261 , P264 , P270 , P271 , P273 , P280 , P301+P310 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+ P340 , P305 + P351+P338 , P310 , P311 , P312 , P314 , P321 , P322 , P330 , P361 , P363 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | niepalny |
| NIOSH (limity ekspozycji na zdrowie w USA): | |
|
PEL (dopuszczalny)
|
nic |
|
REL (zalecane)
|
TWA 0,05 ppm (0,2 mg/ m3 ) |
|
IDLH (bezpośrednie zagrożenie)
|
ND |
| Karta charakterystyki (SDS) | Oxford MSDS |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Chlorek chloroacetylu to chlorowany chlorek acylu . Jest to związek dwufunkcyjny , co czyni go użytecznym budulcem chemicznym.
Produkcja
Przemysłowo jest wytwarzany przez karbonylowanie chlorku metylenu , utlenianie chlorku winylidenu lub dodanie chloru do ketenu . Można go otrzymać z kwasu chlorooctowego i chlorku tionylu , pięciochlorku fosforu lub fosgenu .
Reakcje
Chlorek chloroacetylu jest dwufunkcyjny – chlorek acylu łatwo tworzy estry i amidy , podczas gdy drugi koniec cząsteczki może tworzyć inne wiązania, np. z aminami. Ilustrujące jest zastosowanie chlorku chloroacetylu w syntezie lidokainy :
Aplikacje
Głównym zastosowaniem chlorku chloroacetylu jest półprodukt w produkcji herbicydów z rodziny chloroacetanilidów, w tym metolachloru , acetochloru , alachloru i butachloru ; szacuje się, że rocznie zużywa się około 100 milionów funtów. Chlorek chloroacetylu jest również używany do produkcji chlorku fenacylu , innego półproduktu chemicznego, używanego również jako gaz łzawiący. Chlorek fenacylu jest syntetyzowany w procesie acylowania benzenu przez Friedela-Craftsa z katalizatorem z chlorku glinu :
Wraz z anizolem służy do syntezy wenlafaksyny .
Bezpieczeństwo
Podobnie jak inne chlorki acylu, w reakcji z innymi związkami protonowymi, takimi jak aminy, alkohole i woda, powstaje kwas solny , który powoduje łzawienie .
Nie ma regulowanego dopuszczalnego limitu narażenia określonego przez Administrację ds. Bezpieczeństwa i Higieny Pracy . Jednak Narodowy Instytut Bezpieczeństwa i Higieny Pracy ustalił zalecany limit narażenia na 0,05 ppm w ciągu ośmiogodzinnego dnia pracy.