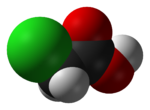
Kwas chlorooctowy

|
|
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Kwas chlorooctowy |
|
|
Systematyczna nazwa IUPAC
Kwas chloroetanowy |
|
| Inne nazwy Kwas 2-chlorooctowy Kwas 2-chloroetanowy |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 3DMet | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.001.072 |
| Numer WE |
|
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS |
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 2 H 3 Cl O 2 | |
| Masa cząsteczkowa | 94,49 g·mol -1 |
| Wygląd | Bezbarwne lub białe kryształy |
| Gęstość | 1,58 g/cm 3 |
| Temperatura topnienia | 63 ° C (145 ° F; 336 K) |
| Temperatura wrzenia | 189,3 ° C (372,7 ° F; 462,4 K) |
| 85,8 g/100 ml (25°C) | |
| Rozpuszczalność | Rozpuszczalny w metanolu , acetonie , eterze dietylowym , benzenie , chloroformie , etanolu |
| dziennik P | 0,22 |
| Ciśnienie pary | 0,22 hPa |
| Kwasowość ( p Ka ) | 2,86 |
| −48,1 × 10 −6 cm3 / mol | |
|
Współczynnik załamania światła ( n D )
|
1.4351 (55°C) |
| Struktura | |
| Jednoskośny | |
| Termochemia | |
|
Pojemność cieplna ( C )
|
144,02 J/(K·mol) |
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−490,1 kJ/mol |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
środek alkilujący |
| Oznakowanie GHS : | |
  
|
|
| Niebezpieczeństwo | |
| H301 , H311 , H314 , H331 , H400 | |
| P260 , P261 , P264 , P270 , P271 , P273 , P280 , P301+P310 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+ P340 , P305 + P351+P338 , P310 , P311 , P312 , P321 , P322 , P330 , P361 , P363 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | 126 ° C (259 ° F; 399 K) |
| 470 ° C (878 ° F; 743 K) | |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
76 mg/kg. |
| Karta charakterystyki (SDS) | Zewnętrzna karta charakterystyki |
| Związki pokrewne | |
|
Związki pokrewne
|
Kwas 2-chloropropionowy Chlorooctan sodu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Kwas chlorooctowy , przemysłowo znany jako kwas monochlorooctowy ( MCA ), jest związkiem chloroorganicznym o wzorze ClCH 2 CO 2 H. Ten kwas karboksylowy jest użytecznym budulcem w syntezie organicznej . Jest to bezbarwne ciało stałe. Związki pokrewne to kwas dichlorooctowy i kwas trichlorooctowy .
Produkcja
Kwas chlorooctowy został po raz pierwszy przygotowany (w postaci nieczystej) przez francuskiego chemika Félixa LeBlanca (1813–1886) w 1843 r. 1919) przez ogrzewanie pod chłodnicą zwrotną lodowatego kwasu octowego w obecności chloru i światła słonecznego, a następnie przez francuskiego chemika Charlesa Adolphe Wurtza przez hydrolizę chlorku chloroacetylu (ClCH 2 COCl), również w 1857 r.
Kwas chlorooctowy jest wytwarzany przemysłowo dwiema drogami. Dominująca metoda polega na chlorowaniu kwasu octowego z bezwodnikiem octowym jako katalizatorem :
-
COOH H3C - Cl2
COOH + →
_ ClH2C - + HCl
Szlak ten cierpi z powodu produkcji kwasu dichlorooctowego i kwasu trichlorooctowego jako zanieczyszczeń, które są trudne do oddzielenia przez destylację :
-
H
3 C-COOH + 2 Cl
2 → Cl
2 HC-COOH + 2 HCl -
H
3 C-COOH + 3 Cl
2 → Cl
3 C-COOH + 3 HCl
Druga metoda polega na hydrolizie trichloroetylenu :
-
ClHC=CCl 2 + 2 H
2 O → ClH
2 C-COOH + 2 HCl
Hydrolizę prowadzi się w temperaturze 130–140 °C w stężonym (co najmniej 75%) roztworze kwasu siarkowego. Ta metoda daje wysoce czysty produkt, w przeciwieństwie do drogi halogenowania. Jednak znaczne ilości uwolnionego HCl doprowadziły do wzrostu popularności drogi halogenowania. Rocznie na całym świecie produkuje się około 420 000 ton.
Zastosowania i reakcje
Większość reakcji wykorzystuje wysoką reaktywność wiązania C – Cl.
W zastosowaniu na największą skalę kwas chlorooctowy jest używany do przygotowania środka zagęszczającego karboksymetylocelulozy i karboksymetyloskrobi .
Kwas chlorooctowy jest również wykorzystywany do produkcji herbicydów fenoksylowych metodą eteryfikacji chlorofenolami. W ten sposób powstaje kwas 2-metylo-4-chlorofenoksyoctowy (MCPA), kwas 2,4-dichlorofenoksyoctowy i kwas 2,4,5-trichlorofenoksyoctowy (2,4,5-T). Jest prekursorem herbicydu glifosatu i dimetoatu . Kwas chlorooctowy jest przekształcany w chlorek chloroacetylu , prekursor adrenaliny (epinefryny). Wypieranie chlorków przez siarczki daje kwas tioglikolowy , który jest stosowany jako stabilizator PVC i składnik niektórych kosmetyków .
Ilustracją jego przydatności w chemii organicznej jest O -alkilowanie aldehydu salicylowego kwasem chlorooctowym, a następnie dekarboksylacja powstałego eteru , z wytworzeniem benzofuranu .
Bezpieczeństwo
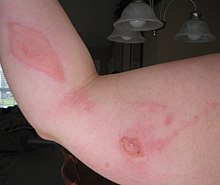
Podobnie jak inne kwasy chlorooctowe i pokrewne halogenowęglowodory, kwas chlorooctowy jest niebezpiecznym środkiem alkilującym . LD50 wynosi . 76 mg/kg
Został sklasyfikowany jako wyjątkowo niebezpieczna substancja w Stanach Zjednoczonych zgodnie z definicją zawartą w sekcji 302 amerykańskiej ustawy o planowaniu kryzysowym i wspólnotowym prawie do wiedzy (42 USC 11002) i podlega ścisłym wymogom zgłaszania przez zakłady produkujące, przechowujące, lub używać go w znacznych ilościach.
Zobacz też
Linki zewnętrzne
- „Kwas monochlorooctowy” . KABB. Zarchiwizowane od oryginału w dniu 6 lutego 2015 r . Źródło 6 lutego 2015 r .
- „Kwas monochlorooctowy” . Firma IPCS Inchem . Źródło 20 maja 2007 .