aldehyd salicylowy
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
2-hydroksybenzaldehyd |
|||
| Inne nazwy Aldehyd salicylowy Aldehyd salicylowy o -Hydroksybenzaldehyd |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 471388 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.001.783 | ||
| Numer WE |
|
||
| 3273 | |||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C7H6O2 _ _ _ _ _ | |||
| Masa cząsteczkowa | 122,123 g·mol -1 | ||
| Gęstość | 1,146 g/ cm3 | ||
| Temperatura topnienia | -7 ° C (19 ° F; 266 K) | ||
| Temperatura wrzenia | 196 do 197 ° C (385 do 387 ° F; 469 do 470 K) | ||
| -64,4· 10-6 cm3 / mol | |||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
 
|
|||
| Ostrzeżenie | |||
| H302 , H315 , H317 , H319 , H335 , H411 | |||
| P280 , P305+P351+P338 | |||
| Karta charakterystyki (SDS) | |||
| Związki pokrewne | |||
|
Związki pokrewne
|
Kwas salicylowy Benzaldehyd Salicylaldoksym |
||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Aldehyd salicylowy (2-hydroksybenzaldehyd) jest związkiem organicznym o wzorze ( ) do 6 H 4 CHO-2-OH. Wraz z 3-hydroksybenzaldehydem i 4 -hydroksybenzaldehydem jest jednym z trzech izomerów hydroksybenzaldehydu . Ta bezbarwna oleista ciecz ma zapach gorzkich migdałów w wyższym stężeniu. Aldehyd salicylowy jest kluczowym prekursorem różnych czynników chelatujących , z których niektóre mają znaczenie handlowe.
Produkcja
Aldehyd salicylowy wytwarza się z fenolu i chloroformu przez ogrzewanie z wodorotlenkiem sodu lub wodorotlenkiem potasu w reakcji Reimera-Tiemanna :
Alternatywnie, jest wytwarzany przez kondensację fenolu lub jego pochodnych z formaldehydem z wytworzeniem alkoholu hydroksybenzylowego, który utlenia się do aldehydu.
Aldehydy salicylowe na ogół można wytwarzać w innych reakcjach orto-selektywnego formylowania z odpowiedniego fenolu, na przykład w reakcji Duffa lub przez traktowanie paraformaldehydem w obecności chlorku magnezu i zasady.
Zjawiska naturalne
Aldehyd salicylowy został zidentyfikowany jako charakterystyczny składnik aromatyczny gryki .
Jest również jednym ze składników kastoreum , wydzieliny z worków rycynowych dojrzałego bobra północnoamerykańskiego ( Castor canadensis ) i bobra europejskiego ( Castorem fiber ), stosowanego w przemyśle perfumeryjnym.
Ponadto aldehyd salicylowy występuje w wydzielinach obronnych larw kilku gatunków chrząszczy liściowych należących do podplemienia Chrysomelina. Przykładem gatunku chrząszcza liściastego, który wytwarza aldehyd salicylowy, jest chrząszcz liściasty topoli czerwonej Chrysomela populi .
Reakcje i aplikacje
Aldehyd salicylowy jest używany do:
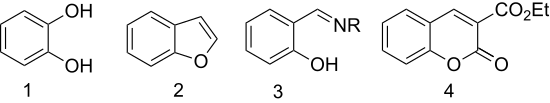
- Utlenianie nadtlenkiem wodoru daje katechol (1,2-dihydroksybenzen) ( reakcja Dakina ).
- Eteryfikacja kwasem chlorooctowym, a następnie cyklizacja daje heterocykliczny benzofuran (kumaron). {Pierwszy etap tej reakcji do podstawionego benzofuranu nazywa się kondensacją Rapa-Stoermera za E. Rapem (1895) i R. Stoermerem (1900).
- Aldehyd salicylowy jest przekształcany w ligandy chelatujące przez kondensację z aminami. Z etylenodiaminą skrapla się, dając ligand salen . Hydroksyloamina daje salicylaldoksym .
- Kondensacja z malonianem dietylu daje 3-karbetoksykumarynę (pochodną kumaryny ) przez kondensację aldolową .