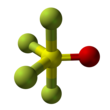
Czterofluorek tionylu

|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
nazwa IUPAC
Czterofluorek tionylu
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| ChemSpider | |||
|
Identyfikator klienta PubChem
|
|||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| SOF 4 | |||
| Wygląd | bezbarwny gaz | ||
| Gęstość | 1,653-0,0036T (°C) ciecz | ||
| Temperatura topnienia | -99,6 ° C (-147,3 ° F; 173,6 K) | ||
| Temperatura wrzenia | −49 ° C (-56 ° F; 224 K) 5090 cal/mol ciepło parowania | ||
| reakcja w wodzie | |||
| dziennik P | 7,2349-859,58/T-26275/T² | ||
| Struktura | |||
| zniekształcona bipiramida trygonalna | |||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
 
|
|||
| Niebezpieczeństwo | |||
| H300 , H310 , H314 , H330 | |||
| P260 , P262 , P264 , P270 , P271 , P280 , P284 , P301+P310 , P301+P330+P331 , P302+P350 , P303 +P361+P353 , P304+P340 , P305 + P351+P338 , P310 , P320 , P321 , P322 , P330 , P361 , P363 , P403+P233 , P405 , P501 | |||
| Związki pokrewne | |||
|
Powiązane oksohalogenki
|
Fluorek tionylu Czterofluorek selenylu |
||
|
Związki pokrewne
|
Trifluorek fosforylu, podfluoryt pentafluorosiarki, fluorek sulfurylu |
||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Czterofluorek tionylu jest nieorganicznym związkiem gazowym o wzorze SO F 4 . Jest również znany jako tlenek tetrafluorku siarki . Kształt cząsteczki to zniekształcona bipiramida trygonalna, z tlenem znajdującym się na równiku. Atomy na równiku mają krótsze wiązania niż atomy fluoru na osi. Wiązanie siarki z tlenem wynosi 1,409Å. Wiązanie AS-F na osi ma długość 1,596Å, a wiązanie S-F na równiku ma długość 1,539Å. Kąt między równikowymi atomami fluoru wynosi 112,8°. Kąt między osią fluoru i tlenu wynosi 97,7°. Kąt między tlenem a równikowym fluorem wynosi 123,6°, a między fluorem osiowym i równikowym 85,7°. Atomy fluoru wytwarzają tylko jeden Linia NMR , prawdopodobnie dlatego, że wymieniają się pozycjami .
Tworzenie
Fluorek tionylu reagujący z gazowym fluorem może wytworzyć tetrafluorek tionylu. W ten sposób gaz został po raz pierwszy odkryty przez Moissana i Lebeau w 1902 roku. Zidentyfikowali oni formułę na podstawie zmian ciśnienia wynikających z reakcji. Fluorek srebra i platyna są zdolne do katalizowania reakcji.
Można go również wytworzyć przez podgrzanie sześciofluorku siarki z powietrzem do temperatury 400°C. Może się to zdarzyć podczas wdychania przez zapalonego papierosa. Lub reakcja difluorku srebra z fluorkiem tionylu w temperaturze 200 stopni. Innym sposobem jego wytworzenia jest elektroliza fluorowodoru z roztworem dwutlenku siarki , który również wytwarza difluorek tlenu i fluorek sulfurylu . Również chlorek tionylu lub fluorek tionylu elektrolizowane fluorowodorem wytwarzały jeszcze więcej gazu.
Reakcje
Czterofluorek tionylu reaguje z wodą, tworząc kwas fluorowodorowy , kwas fluorowodorowy i difluorek sulfurylu . Rtęć może usuwać fluor, tworząc fluorek tionylu i fluorek rtęci . Silne zasady powodują powstawanie jonów fluorkowych i fluorosiarczanowych .
Kliknij chemię
Czterofluorek tionylu można stosować w chemii kliknięć w reakcjach z pierwszorzędowymi aminami znanymi jako wymiana fluorku siarki (VI) (SuFEx). Ten rodzaj reakcji był pierwszą reakcją „kliknięcia”, która wygenerowała trójwymiarowy rdzeń.
- ^ a b c d e f Harry Julius Emeléus i AG Sharpe Advances in Inorganic Chemistry Tom 2 Academic Press 1960 strona 117 [1]
- Bibliografia _ _ _ _
- ^ „Właściwości gazu SF6” .
- Bibliografia _ „Podfluoryn pentafluorosiarki i tetrafluorek tionylu”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 78 (8): 1553–1557. doi : 10.1021/ja01589a013 .
- ^ Shunji Nagase Fluorowanie nieorganicznych związków siarki Biuletyn Towarzystwa Chemicznego Japonii, tom 42, strona 2062 1968
- Bibliografia _ Wu, Peng; Mojżesz, Jan E.; Sharpless, K. Barry (2017-02-01). „Wielowymiarowa chemia kliknięć SuFEx: sekwencyjne połączenia wymiany fluorków siarki (VI) różnych modułów uruchamianych z koncentratora SOF4” . Angewandte Chemie wydanie międzynarodowe . 56 (11): 2903–2908. doi : 10.1002/anie.201611048 . ISSN 1521-3773 . PMC 5434761 . PMID 28165188 .