Hem C
|
|
| Identyfikatory | |
|---|---|
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Siatka | hem+C |
|
Identyfikator klienta PubChem
|
|
|
|
|
|
| Nieruchomości | |
| C34H36O4N4S2Fe _ _ _ _ _ _ _ _ _ _ | |
| Masa cząsteczkowa | 684,64904 g/mol |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
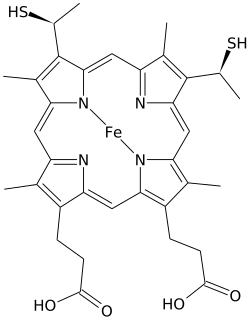
Hem C (lub hem C ) jest ważnym rodzajem hemu .
Historia
Prawidłową budowę hemu C opublikował w połowie XX wieku szwedzki biochemik K.-G. Paweł. Praca ta potwierdziła strukturę wywnioskowaną po raz pierwszy przez wielkiego szwedzkiego biochemika Hugo Theorella . Strukturę hemu C, opartą na eksperymentach NMR i IR zredukowanej formy hemu Fe(II), potwierdzono w 1975 roku. Strukturę hemu C, w tym absolutną konfigurację stereochemiczną wokół wiązań tioeterowych, przedstawiono po raz pierwszy dla białko kręgowców, cytochrom c, a obecnie obejmuje wiele innych białek zawierających hem C.
Nieruchomości
Hem C różni się od hemu B tym, że dwa winylowe łańcuchy boczne hemu B są zastąpione kowalencyjnymi wiązaniami tioeterowymi z apoproteiną . Dwa tioeterowe są zwykle tworzone przez reszty cysteiny białka. Te wiązania nie pozwalają hemowi C na łatwą dysocjację od holoproteiny , cytochromu c , w porównaniu z łatwiej dysocjującym hemem B, który może dysocjować od holoproteiny, kompleksu hem-białko, nawet w łagodnych warunkach. Pozwala to na bardzo szeroki zakres struktury i funkcji cytochromu c, przy czym niezliczone cytochromy typu c działają głównie jako nośniki elektronów. Potencjał redoks cytochromu c można również „dostroić” za pomocą niewielkich zmian w strukturze białka i interakcji rozpuszczalników.
Liczba jednostek hemu C związanych z holoproteiną jest bardzo zmienna. Dla komórek kręgowców regułą jest jeden hem C na białko, ale dla bakterii liczba ta wynosi często 2, 4, 5, 6 lub nawet 16 grup hemu C na holoproteinę. Powszechnie uważa się, że liczba i układ grup hemu C są powiązane, a nawet wymagane do prawidłowego funkcjonowania holoprotein. Na przykład te białka, które zawierają kilka grup C hemu, biorą udział w wielu reakcjach przenoszenia elektronów, szczególnie ważna jest redukcja 6 elektronów wymagana do redukcji azotu atmosferycznego do dwóch organicznych cząsteczek amoniaku. Często zdarza się, że stosunek hemu C do aminokwasów jest wysoki dla bakterii hemeproteins , więc wnętrza niektórych białek cytochromu c wydają się być wypełnione wieloma grupami hemu C w porównaniu z innymi białkami heme. Niektóre białka hemowe, często pochodzące z organizmów jednokomórkowych , mogą zawierać pięć hemów C. Kompleks bc 1 to kolejny ważny enzym, który zawiera hem typu C.
Wydaje się, że wiązania tioeterowe zapewniają dużą swobodę działania holoprotein. Ogólnie rzecz biorąc, cytochromy typu c można „dostroić” w szerszym zakresie potencjału oksydacyjno-redukcyjnego niż cytochromy b. Może to być ważny powód, dla którego cytochrom c jest prawie wszechobecny przez całe życie. Hem C odgrywa również ważną rolę w apoptozie , gdzie zaledwie kilka cząsteczek cytoplazmatycznego cytochromu c, który musi jeszcze zawierać hem C, prowadzi do zaprogramowanej śmierci komórki. Cytochrom c można mierzyć w ludzkiej surowicy i można go stosować jako marker stanu zapalnego.
Oprócz tych równikowych wiązań kowalencyjnych, żelazo hemowe jest również zwykle skoordynowane osiowo z łańcuchami bocznymi dwóch aminokwasów , co czyni żelazo sześciokoordynacyjnym. Na przykład cytochrom c ssaków i tuńczyka zawiera pojedynczy hem C, który jest osiowo skoordynowany z łańcuchami bocznymi zarówno histydyny , jak i metioniny . Być może z powodu dwóch wiązań kowalencyjnych utrzymujących hem z białkiem, żelazo hemu C jest czasami przyłączane osiowo do grupy aminowej lizyny lub nawet wody.
- ^ Paweł, KG; Högfeldt, Erik; Sillen, Lars Gunnar; Kinell, Per-Olof (1950). „Rozszczepienie solami srebra wiązań cysteina-porfiryna w cytochromie c” . Acta Chemica Scandinavica . 4 : 239–244. doi : 10.3891/acta.chem.scand.04-0239 .
- Bibliografia _ Smythe, Georgia; O'Keeffe, DH; Maskasky, JE; Smith, ML (1975). „Hem A oksydazy cytochromu c” . Dziennik Chemii Biologicznej . 250 (19): 7602–7622. doi : 10.1016/S0021-9258(19)40860-0 . PMID 170266 .
- Bibliografia _ Trus BL; Mandel N.; Mandela G.; Kallai OB; Swanson R.; Dickerson RE (1977). „Cytochrom c tuńczyka w rozdzielczości 2,0 A. II. Analiza struktury ferrocytochromu” . Dziennik Chemii Biologicznej . 252 (2): 776–785. doi : 10.1016/S0021-9258(17)32784-9 . PMID 188826 .
- Bibliografia _ Brayer, GD (1992). „Zależne od stanu utlenienia zmiany konformacyjne cytochromu c”. J. Mol. Biol . 223 (4): 959–976. doi : 10.1016/0022-2836(92)90255-i . PMID 1311391 .
-
^
Gwyer James D., Richardson David J., Butt Julea N. (2005). „Charakterystyka diody lub diody tunelowej? Rozwiązywanie katalitycznych konsekwencji transferu elektronów sprzężonych z protonami w wieloośrodkowej oksydoreduktazie”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 127 (43): 14964–14965. doi : 10.1021/ja054160s . PMID 16248601 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) -
^
Bowman, SEJ, Bren, KL (2008). „Chemia i biochemia hemu C: funkcjonalne podstawy przyłączenia kowalencyjnego” . Nat. Szturchać. przedstawiciel _ 25 (6): 1118–1130. doi : 10.1039/b717196j . PMC 2654777 . PMID 19030605 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) - Bibliografia _ Pissas, G.; Liakopoulos, V.; Stafanidis, I. (2016). „Cytochrom c jako potencjalnie użyteczny klinicznie marker uszkodzeń mitochondriów i komórek” . Przód. immunol . 7 : 279. doi : 10.3389/fimmu.2016.00279 . PMC 4951490 . PMID 27489552 .
-
^
Yeh, SR, Han, S. i Rousseau, DL (1998). „Składanie i rozwijanie cytochromu c”. Rachunki badań chemicznych . 31 (11): 727–735. doi : 10.1021/ar970084p .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link )