IQGAP1
| IQGAP1 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , HUMORFA01, SAR1, p195, motyw IQ zawierający białko aktywujące GTPazę 1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Ras białko aktywujące GTPazę IQGAP1 (IQGAP1), znane również jako p195 , jest wszechobecnym białkiem , które u ludzi jest kodowane przez gen IQGAP1 . IQGAP1 jest białkiem rusztowania zaangażowanym w regulację różnych procesów komórkowych, od organizacji cytoszkieletu aktynowego , transkrypcji i adhezji komórkowej po regulację cyklu komórkowego .
Historia
IQGAP1 został odkryty w 1994 roku. Jego nazwa wynika z faktu, że jego domena związana z RasGAP (GRD) wykazuje homologię sekwencji z GTPazą Sar1 . Postawiono hipotezę, że IQGAP1 będzie działać jako białko aktywujące GTPazę (GAP), promując zmianę GTPaz ras z aktywnych form GTP na formy związane z GDP. Jednak pomimo homologii domeny GAP IQGAP z sar1 i faktu, że IQGAP1 wiąże GTPazy Rho Rac1 i Cdc42, IQGAP w rzeczywistości nie pełni funkcji GAP. Zamiast tego wiąże aktywne (związane z GTP) formy RAC1 i CDC42 z wyższym powinowactwem niż formy związane z GDP i stabilizuje formę aktywną in vivo.
IQGAP1 jest obecnie rozpoznawany jako rusztowanie białkowe, które integruje sygnały regulujące adhezję komórek , cytoszkielet aktynowy , cykl komórkowy i inne funkcje komórkowe. IQGAP jest szczególnie interesujący jako cel terapeutyczny, ponieważ działa jako węzeł dla tak wielu szlaków sygnałowych zaangażowanych w raka .
Wyrażenie
Analiza ekspresji IQGAP1 w tkankach ludzkich wykazała, że rusztowanie jest mniej lub bardziej wszechobecne. Zwykle znajduje się w jądrze , błonie komórkowej i cytoplazmie . Innymi słowy, występuje w całej komórce, jak również we wszystkich rodzajach tkanek. Analiza ekspresji wykazała również, że IQGAP1 ulega nadekspresji w wielu nowotworach, aw bardziej agresywnych rakach jelita grubego i jajnika IQGAP1 jest zlokalizowany na inwazyjnym froncie nowotworu, co wskazuje na rolę w mobilizacji komórek. Co ważne, około 10% genów wykazujących zwiększoną ekspresję w przerzutach komórki są partnerami wiążącymi IQGAP1.
Domeny
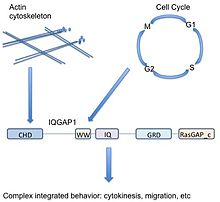
IQGAP1 jest białkiem o masie 190 kDa z 5 domenami. Domena białkowa to podsekcja białka, która pojawia się wielokrotnie w biologii i może istnieć niezależnie od otaczającego białka. Jest bardzo podobny do podsekcji innych białek i może zostać wycięty z obecnego białka, istnieć i funkcjonować samodzielnie lub zostać wklejony do nowej nici białka i nadal działać prawidłowo. Ponieważ ten obszar białka jest zachowany w sekwencji i strukturze aminokwasowej, można go scharakteryzować na podstawie funkcji lub partnera wiązania. IQGAP1 ma 5 dobrze znanych domen oddzielonych innymi aminokwasami.
Począwszy od N-końca (lub z przodu białka), IQGAP1 zawiera domenę homologii kalponiny (CHD), która pośredniczy w wiązaniu aktyny i wiąże kalponinę .
WW lub domena białko-białko poliproliny , nazwana tak z powodu dwóch funkcjonalnie konserwowanych tryptofanów, W, jest domeną interakcji białko-białko, która wiąże się z bogatymi w prolinę regionami innych białek.
domenie WW następują 4 motywy IQ , które tworzą domenę IQ. Ta domena wiąże kalmodulinę , białko znane jako czujnik wapnia, które może wiązać i regulować wiele docelowych białek.
GRD (domena związana z rasGAP) następuje po domenie IQ. Ta domena jest bardzo podobna do funkcjonalnej podjednostki białek aktywujących GTPazę Ras (GAP) i dlatego uważano, że pełni funkcję GAP. IQGAP1 wiąże GTPazy Rho CDC42 i RAC1 , jednak IQGAP1 jest niezwykły, ponieważ w rzeczywistości nie pełni funkcji GAP, a zamiast tego stabilizuje białka związane z GTP w ich stanie aktywnym.
Wreszcie, IQGAP1 ma końcową sekwencję karboksylową RasGAP_c ważną dla wiązania beta-kateniny i E-kadheryny .
Powiązane białka
Homologi IQGAP1 są znane u gatunków tak różnych, jak drożdże, robaki i ludzie (a także inne ssaki), chociaż domeny nie zawsze są wysoce konserwatywne.
IQGAP1 jest najlepiej zbadanym członkiem rodziny białek rusztowania IQGAP. Dwóch innych członków rodziny to IQGAP2 i IQGAP3, które mają znacznie bardziej ograniczone wzorce ekspresji w porównaniu z IQGAP1. IQGAP2 znajduje się w wątrobie, żołądku i płytkach krwi i jest w 62% identyczny z IQGAP1, ale wydaje się, że ma drastycznie rozbieżną funkcję pod względem patologii.
W mózgu IQGAP3 wydaje się odgrywać ważną rolę w morfogenezie neuronów.
Funkcjonować
Ten gen koduje członka rodziny IQGAP . Białko zawiera cztery domeny IQ , jedną domenę homologii kalponiny , jedną domenę Ras-GAP i jedną domenę WW . Oddziałuje ze składnikami cytoszkieletu, takimi jak formina Dia1 ( mDia1 ), z cząsteczkami adhezyjnymi komórek ( CAM ) oraz z kilkoma cząsteczkami sygnałowymi, regulując morfologię i ruchliwość komórek . Na przykład ekspresja IQGAP1 jest niezbędna do wzrostu procesu neuronalnego na cząsteczce adhezyjnej komórki PTPmu ( PTPRM ). Ekspresja białka jest regulowana w górę przez amplifikację genu w dwóch raka żołądka , a jego nadekspresję i wyraźną lokalizację w błonie obserwuje się również w szeregu nowotworów.
Interakcje
IQGAP1 to węzeł przecinany przez wiele szlaków sygnałowych. Jako taka ma wielu partnerów wiążących, z których wielu odgrywa zasadniczą rolę w kontrolowaniu cyklu komórkowego i cytoszkieletu aktynowego.
Wykazano, że IQGAP1 wchodzi w interakcje z:
- Kalmodulina 1 ,
- CDC42 ,
- CDH1 ,
- KLIP1 ,
- PRKACA ,
- RAC1 i
- S100B .
- Aktyna – budowa cytoszkieletu
- ARF6
- APC
- Beta-katenina – adhezja komórek i sygnalizacja WNT: transkrypcja
- B-raf – MAPK
- CD44
- Erk1/2 – szlak MAPK, kontrola cyklu komórkowego, proliferacja
- Mek ½ -- Szlak MAPK, kontrola cyklu komórkowego, proliferacja
- Src
- PTPmu ( PTPRM )
- pełna lista o godz
Funkcjonować jako rusztowanie
Wiązanie z białkami samo w sobie nie tworzy interesującej historii. O wiele ważniejszy jest wynik wiążącego wydarzenia. Czy wiązanie zmienia lokalizację docelowego białka? Czy aktywuje cel lub w jakiś sposób zmienia konformację celu (lub cząsteczki efektorowej)? Jako białko rusztowania , IQGAP1 wiąże i reguluje wiele celów - jego rolą jest integracja i pośredniczenie w sygnalizacji z różnych szlaków oraz izolowanie kluczowych członków szlaku przed przesłuchem .
Rusztowania organizują szlaki sygnalizacyjne — pomagają regulować, w jaki sposób różne sygnały zewnątrzkomórkowe mogą być transdukowane przez te same kanoniczne elementy szlaku do różnych wyjść komórkowych. Ogólnie rzecz biorąc, rusztowania regulują wydajność, lokalizację i selektywność ścieżek.
Jako rusztowanie zaangażowane w różne szlaki sygnałowe ( cytoszkielet aktynowy , adhezja komórkowa , cykl komórkowy , transkrypcja), IQGAP1 ma wyjątkową zdolność do potencjalnego łączenia różnych funkcji komórkowych. Na przykład IQGAP1 jest związany z dynamiką aktyny poprzez bezpośrednie wiązanie aktyny i pośrednią regulację poprzez Cdc42/Rac1, ale także moduluje szlak MAPK , który jest związany z kontrolą cyklu komórkowego. Zatem IQGAP1 może łączyć sygnalizację MAPK (decyzje dotyczące losu komórki ) do cytoszkieletu lub adhezji komórkowej (potencjalnie realizując te decyzje) - ważna implikacja dla raka.
Upraszczając, ze względu na różnorodny zakres partnerów wiążących, IQGAP1 może działać jako łącznik między logicznie powiązanymi, ale molekularnie odrębnymi funkcjami komórkowymi. W powyższym przykładzie przegrupowanie cytoszkieletu aktynowego jest wymagane do proliferacji ( cytokineza podczas mitozy ). IQGAP1 pomaga komórkom zarówno nasłuchiwać, jak i działać na sygnały, odgrywając integralną rolę w łączeniu kropek między sygnałami proliferacji a rzeczywistą odpowiedzią komórkową.
Kluczowe ścieżki
MAPA ERK
Ras → Raf → MEK → ERK MAPK odgrywa integralną rolę w procesach proliferacji , różnicowania i apoptozy komórek . Ta ścieżka jest konserwowana u wszystkich eukariontów .
Różne sygnały zewnątrzkomórkowe indukują szlak ERK MAPK, w tym EGF , IGF-1 , PDGF i NGF . Różne rusztowania tego szlaku, w tym IQGAP1, są odpowiedzialne za modulowanie odpowiedzi komórkowej na aktywność tego szlaku. Na przykład w danej linii komórkowej aktywacja przez jeden sygnał zewnątrzkomórkowy może indukować różnicowanie, ale nie proliferację, podczas gdy aktywacja tego samego szlaku ERK MAPK przez inny sygnał zewnątrzkomórkowy będzie indukować proliferację, ale nie różnicowanie. Wydaje się, że IQGAP1 jest odpowiedzialny za specyficzne wyjście szlaku po aktywacji przez EGF.
IQGAP1 odgrywa znaczącą rolę w propagacji tego szlaku sygnałowego MAPK. IQGAP bezpośrednio wiąże b-RAF , MEK1/2 i ERK1/2 i jest faktycznie niezbędny do fosforylacji (aktywacji) ERK po stymulacji przez EGF.
Kontrola cytoszkieletu (dynamika aktyny)
Aktyna jest głównym budulcem cytoszkieletu każdej komórki eukariotycznej. Dynamika aktyny odgrywa główną rolę w ruchliwości komórki (włókna są budowane na krawędzi natarcia poruszającej się komórki i dekonstruowane na krawędzi cofającej się). IQGAP1 wiąże aktynę i wpływa na dynamikę aktyny, lokalizując się w czołówce i rekrutując maszynerię polimeryzacji aktyny .
IQGAP1 wiąże się i jest celem GTPaz Rho CDC42 i RAC1 , które są dobrze znanymi regulatorami cytoszkieletu aktynowego. Pomimo swojej nazwy, IQGAP1 nie posiada funkcji GAP, a zamiast tego stabilizuje aktywne Cdc42. Ten wzrost lokalnej puli aktywnego Cdc42 stymuluje tworzenie włókien aktynowych , a tym samym tworzenie filopodiów .
IQGAP1 może sieciować aktynę, aw wielu organizmach IQGAP1 bierze udział w cytokinezie .
Przyczepność
Kadheryny to rodzina białek adhezyjnych, które lokalizują się na powierzchni komórki, gdzie zakotwiczają komórkę do sąsiadów, przyczepiając się do zewnątrzkomórkowej części kadheryn sąsiada. Aktyna wiąże a-kateninę , która wiąże beta-kateninę , która z kolei wiąże E-kadherynę . E-kadheryna wystaje do przestrzeni zewnątrzkomórkowej, aby uchwycić zewnątrzkomórkowe domeny sąsiednich E-kadheryny. IQGAP1 lokalizuje się w kontaktach komórka-komórka i wiąże aktynę, b-kateninę i E-kadherynę, osłabiając te połączenia, a tym samym zmniejszając adhezję komórka-komórka. IQGAP osłabia adhezję komórek poprzez wypieranie a-kateniny z kompleksu.
Aktywny RAC1 wiąże IQGAP1 z sieciującymi włóknami aktynowymi i zapobiega interakcji IQGAP1 z beta-kateniną , stabilizując kontakty komórka-komórka . Jednak gdy IQGAP1 nie wiąże Rac1, wiąże beta-kateninę, wypierając a-kateninę z kompleksu adhezji komórkowej kadheryna-katenina.
Transkrypcja
IQGAP1 wpływa również na transkrypcję poprzez szlak sygnałowy Wnt poprzez interakcję z beta-kateniną . Beta-katenina jest zwykle zamaskowana w kompleksie i wykluczona z jądra, ale po aktywacji WNT kompleks ten zostaje rozbity i beta-katenina przemieszcza się do jądra, gdzie aktywuje programy transkrypcyjne. IQGAP1 wiąże b-kateninę i zwiększa lokalizację jądrową oraz ekspresję celów transkrypcyjnych beta-kateniny.
Znaczenie kliniczne
IQGAP1 jest związany z dynamiką cytoszkieletu , transkrypcją, adhezją komórek , cyklem komórkowym i morfologią , z których wszystkie są zaburzone w raku . Jako białko modulujące przecinające wszystkie te szlaki, IQGAP1 może sprzęgać wiele z nich, a także odpowiada za ich prawidłową propagację. Ponieważ rak jest chorobą charakteryzującą się zaburzeniem wielu z tych procesów komórkowych, IQGAP1 jest logicznym na onkogen i celem terapeutycznym.
Analiza ekspresji implikuje IQGAP1 w raku jelita grubego , płaskonabłonkowego , piersi , żołądka , wątroby , płuc i jajnika , aw niektórych z tych nowotworów wyższe poziomy ekspresji IQGAP1 wskazują na złe rokowanie.
Aby rak dał przerzuty , komórki muszą zdobyć zdolności migracyjne i zaatakować inne tkanki. Poprzez Rac1/CDC42, IQGAP1 reguluje adhezję komórkową i dynamikę aktyny.
W normalnych komórkach IQGAP1 lokalizuje się w obszarach o wysokim obrocie aktyną. Ta cecha znajduje odzwierciedlenie w tkankach inwazyjnych, gdzie IQGAP1 lokalizuje się na przedniej krawędzi migrujących komórek. Nadekspresja IQGAP1 była związana ze zwiększoną migracją i inwazją w linii komórkowej ludzkiego raka nabłonka sutka ( MCF-7 ). IQGAP1 może być również zaangażowany w deregulację proliferacji i różnicowania poprzez modulację szlaku ERK MAPK .
IQGAP1 może być niezbędny do powstawania nowotworów . Knockdown IQGAP1 w komórkach rakowych MCF-7 zmniejszył złośliwy (proliferacja zależna od surowicy i wzrost niezależny od zakotwiczenia). U 100% myszy, którym wstrzyknięto komórki MCF-7 z nadekspresją IQGAP1, rozwinęły się nowotwory, które były wysoce inwazyjne. Kontrolne komórki MCF-7 tworzyły guzy u 60% myszy, a komórki MCF-7 ze stabilnym knockdownem IQGAP1 tworzyły guzy tylko w 20% przypadków. Bardzo interesujący jest mechanizm, w jaki IQGAP1 może modulować powstawanie nowotworów / inwazję poprzez różnych partnerów wiążących.
Myszy zerowe IQGAP1 wydają się znacznie normalne, a jedyną nieprawidłowością w historii życia jest wzrost rozrostu żołądka . Zatem IQGAP1 może być skutecznym celem terapeutycznym, jeśli jego knockdown ma niewielki wpływ na homeostatyczną , ale jego ekspresja jest ważna w raku.
Dalsza lektura
- Tirnauer JS (2004). „Nowe połączenie cytoszkieletu dla APC: połączone z aktyną przez IQGAP” . Dev. komórka . 7 (6): 778–80. doi : 10.1016/j.devcel.2004.11.012 . PMID 15572120 .
- McCallum SJ, Wu WJ, Cerione RA (1996). „Identyfikacja domniemanego efektora dla Cdc42Hs o wysokim podobieństwie sekwencji do białka IQGAP1 związanego z RasGAP i partnera wiążącego Cdc42Hs o podobieństwie do IQGAP2” . J. Biol. chemia . 271 (36): 21732-7. doi : 10.1074/jbc.271.36.21732 . PMID 8702968 .
- Bashour AM, Fullerton AT, Hart MJ, Bloom GS (1997). „IQGAP1, białko wiążące Rac i Cdc42, bezpośrednio wiąże i sieciuje mikrofilamenty” . J. Cell Biol . 137 (7): 1555–66. doi : 10.1083/jcb.137.7.1555 . PMC 2137827 . PMID 9199170 .
- McCallum SJ, Erickson JW, Cerione RA (1998). „Charakterystyka asocjacji białka wiążącego aktynę, IQGAP i aktywowanego Cdc42 z błonami Golgiego” . J. Biol. chemia . 273 (35): 22537–44. doi : 10.1074/jbc.273.35.22537 . PMID 9712880 .
- Sugimoto N, Imoto I, Fukuda Y, Kurihara N, Kuroda S, Tanigami A, Kaibuchi K, Kamiyama R, Inazawa J (2001). „IQGAP1, negatywny regulator adhezji komórka-komórka, jest regulowany w górę przez amplifikację genu w 15q26 w liniach komórkowych raka żołądka HSC39 i 40A” . J. Hum. Genet . 46 (1): 21–5. doi : 10.1007/s100380170119 . PMID 11289714 .
- Nabeshima K, Shimao Y, Inoue T, Koono M (2002). „Immunohistochemiczna analiza ekspresji IQGAP1 w ludzkich rakach jelita grubego: jego nadekspresja w rakach i powiązanie z frontami inwazji”. Rak Lett . 176 (1): 101–9. doi : 10.1016/S0304-3835(01)00742-X . PMID 11790459 .
- Mateer SC, McDaniel AE, Nicolas V, Habermacher GM, Lin MJ, Cromer DA, King ME, Bloom GS (2002). „Mechanizm regulacji aktywności wiązania F-aktyny IQGAP1 przez wapń / kalmodulinę” . J. Biol. chemia . 277 (14): 12324–33. doi : 10.1074/jbc.M109535200 . PMID 11809768 .
- Swart-Mataraza JM, Li Z, Sacks DB (2002). „IQGAP1 jest składnikiem sygnalizacji Cdc42 do cytoszkieletu” . J. Biol. chemia . 277 (27): 24753–63. doi : 10.1074/jbc.M111165200 . PMID 11948177 .
- Brandt DT, Marion S, Griffiths G, Watanabe T, Kaibuchi K, Grosse R (lipiec 2007). „Dia1 i IQGAP1 współdziałają w migracji komórek i tworzeniu kubków fagocytarnych” . J. Cell Biol . 178 (2): 193–200. doi : 10.1083/jcb.200612071 . PMC 2064439 . PMID 17620407 .