PRKACA
| PRKACA | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , PKACA, PPNAD4, kinaza białkowa aktywowana przez cAMP podjednostka katalityczna alfa, | |||||||||||||||||||||||||||||||||||||||||||||||
| identyfikatory zewnętrzne CAFD1 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Katalityczna podjednostka α kinazy białkowej A jest kluczowym enzymem regulatorowym , który u ludzi jest kodowany przez gen PRKACA . Enzym ten odpowiada za fosforylację innych białek i substratów, zmieniając ich aktywność. Kinaza białkowa Podjednostka katalityczna (PKA Cα) należy do rodziny kinaz AGC (kinazy białkowe A, G i C ) i bierze udział w kontroli procesów komórkowych, w tym metabolizmu glukozy , podziałów komórkowych i pamięć kontekstowa. PKA Cα jest częścią większego kompleksu białkowego, który jest odpowiedzialny za kontrolowanie, kiedy i gdzie białka są fosforylowane. holoenzymu PKA została powiązana z postępem chorób sercowo-naczyniowych, niektórymi zaburzeniami endokrynologicznymi i nowotworami.
Odkrycie
Edmond H. Fischer i Edwin G. Krebs z University of Washington odkryli PKA pod koniec lat pięćdziesiątych XX wieku, pracując nad mechanizmami rządzącymi fosforylazą glikogenu . Zdali sobie sprawę, że kluczowy enzym metaboliczny zwany kinazą fosforylazy był aktywowany przez inną kinazę zależną od cyklicznego AMP drugiego przekaźnika (obóz). Nazwali ten nowy enzym kinazą białkową zależną od cAMP i przystąpili do oczyszczania i charakteryzowania tego nowego enzymu. Fischer i Krebs zdobyli Nagrodę Nobla w dziedzinie fizjologii lub medycyny w 1992 roku za to odkrycie i dalsze prace nad kinazami i ich odpowiednikami, fosfatazami białkowymi . Obecnie ta kinaza białkowa zależna od cAMP jest określana prościej jako PKA.
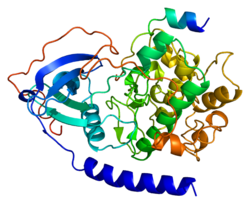
Kolejne kluczowe wydarzenie w historii PKA miało miejsce, gdy Susan Taylor i Janusz Sowadski z Uniwersytetu Kalifornijskiego w San Diego rozwiązali trójwymiarową strukturę katalitycznej podjednostki enzymu. Odkryto również, że wewnątrz komórek podjednostki katalityczne PKA występują w kompleksach z podjednostkami regulatorowymi i białkami hamującymi, które blokują aktywność enzymu. Dodatkowym aspektem działania PKA, zapoczątkowanym przez Johna Scotta z University of Washington i Kjetila Taskena z University of Oslo, jest to, że enzym jest związany w komórce poprzez powiązanie z rodziną Białka kotwiczące kinazę A (AKAP). Doprowadziło to do hipotezy, że subkomórkowa lokalizacja zakotwiczonej PKA kontroluje, które białka są regulowane przez kinazę.
Podjednostki katalityczne
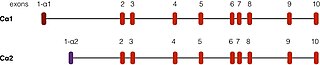
PRKACA znajduje się na chromosomie 19 u ludzi. Istnieją dwa dobrze opisane transkrypty tego genu, powstałe w wyniku alternatywnego splicingu . Najbardziej powszechna forma, zwana Cα1, jest wyrażana w tkankach ludzkich. Inny transkrypt, zwany Cα2, znajduje się głównie w plemnikach i różni się od Cα1 tylko pierwszymi 15 aminokwasami .
Ponadto istnieją dwie inne izoformy podjednostki katalitycznej PKA, zwane Cβ i Cγ, pochodzące z różnych genów, ale pełniące podobne funkcje jak Cα. Cβ występuje obficie w mózgu iw mniejszych ilościach w innych tkankach, podczas gdy Cγ jest najprawdopodobniej wyrażany w jądrach.
Sygnalizacja

Nieaktywny holoenzym PKA istnieje jako tetramer składający się z dwóch podjednostek regulatorowych (R) i dwóch podjednostek katalitycznych (C). Badania biochemiczne wykazały, że istnieją dwa rodzaje podjednostek R. Podjednostki typu IR, których istnieją dwie izoformy (RIα i RIβ) wiążą podjednostki katalityczne, tworząc holoenzym PKA typu I. Podobnie podjednostki typu II R, których są dwie izoformy (RIIα i RIIβ), tworzą holoenzym PKA typu II. W obecności cAMP każda podjednostka R wiąże 2 cząsteczki cAMP i powoduje zmianę konformacyjną podjednostek R, która uwalnia podjednostki C w celu fosforylacji dalszych substratów. Różne podjednostki R różnią się wrażliwością na cAMP, poziomami ekspresji i lokalizacjami subkomórkowymi. Białka kotwiczące kinazę A (AKAP) wiążą powierzchnię utworzoną między obiema podjednostkami R i kierują kinazę do różnych miejsc w komórce. Optymalizuje to miejsce i czas komunikacji komórkowej w komórce.
Znaczenie kliniczne
Kinaza białkowa A jest związana z wieloma chorobami, w tym chorobami układu krążenia, nowotworami kory nadnerczy i rakiem. Spekulowano, że nienormalnie wysoki poziom fosforylacji PKA przyczynia się do chorób serca. Wpływa to na sprzężenie pobudzenie-skurcz, które jest procesem rytmicznym, który kontroluje skurcz mięśnia sercowego poprzez zsynchronizowane działanie enzymów reagujących na wapń i cAMP . Istnieją również dowody potwierdzające, że błędna lokalizacja sygnalizacji PKA przyczynia się do zaburzeń rytmu serca , szczególnie Zespół długiego QT . Powoduje to nieregularne bicie serca, które może spowodować nagłą śmierć.
Mutacje w genie PRKACA , które promują nieprawidłową aktywność enzymatyczną, zostały powiązane z chorobą nadnerczy. U pacjentów z zespołem Cushinga stwierdzono kilka mutacji w PRKACA , które skutkują zwiększeniem zdolności PKA do szerokiej fosforylacji innych białek. Jedną mutację w PRKACA , która powoduje zamianę aminokwasu leucyny na argininę w pozycji 206, stwierdzono u ponad 60% pacjentów z guzami kory nadnerczy . Inne mutacje i zmiany genetyczne w PRKACA został zidentyfikowany w gruczolakach kory nadnerczy , które również zakłócają sygnalizację PKA, prowadząc do nieprawidłowej fosforylacji PKA. Gen Cα został również oskarżony o różne nowotwory, w tym raka okrężnicy, nerek, odbytnicy, prostaty, płuc, piersi, nadnerczy i chłoniaki.
Ostatnio obserwuje się rosnące zainteresowanie rakiem wątrobowokomórkowym włóknisto-płytkowym . Molekularnym podłożem tej rzadkiej postaci raka wątroby, która dotyka młodych dorosłych, jest genetyczna delecja chromosomu 19. Utratę DNA stwierdzono u bardzo wysokiego odsetka pacjentów. Konsekwencją tej delecji jest nieprawidłowa fuzja dwóch genów – DNAJB1 , który jest genem kodującym białko szoku cieplnego 40 (Hsp40) i PRKACA . Dalsze analizy tkanek włóknisto-płytkowego raka wątrobowokomórkowego wykazują wzrost poziomu białka tego białka fuzyjnego DNAJ-PKAc. Jest to zgodne z hipotezą, że zwiększona aktywność kinazy w tkankach wątroby może inicjować lub utrwalać tę rzadką postać raka wątroby. Biorąc pod uwagę bogactwo informacji na temat trójwymiarowych struktur DNAJ i PKA Cα, istnieje pewna nadzieja na opracowanie nowych leków ukierunkowanych na tę nietypową i potencjalnie rakotwórczą kinazę fuzyjną.
Notatki
Linki zewnętrzne
- PDBe-KB zawiera przegląd wszystkich informacji o strukturze dostępnych w PDB dla ludzkiej podjednostki katalitycznej kinazy białkowej zależnej od cAMP alfa (PRKACA)