Idebenon
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Catena, Raxone, Sovrima |
| AHFS / Drugs.com | Międzynarodowe nazwy leków |
| Dane licencyjne | |
| Kod ATC | |
| Status prawny | |
| Status prawny |
|
| Dane farmakokinetyczne | |
| Biodostępność | <1% (wysoki efekt pierwszego przejścia ) |
| Wiązanie białek | >99% |
| Okres półtrwania w fazie eliminacji | 18 godzin |
| Wydalanie | Mocz (80%) i kał |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
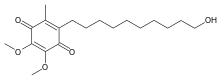
| Formuła | C19H30O5 _ _ _ _ _ |
| Masa cząsteczkowa | 338,444 g · mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Idebenon (wymawiane eye- deb -eh-znany, nazwy handlowe Catena , Raxone , Sovrima , między innymi) to lek , który został pierwotnie opracowany przez Takeda Pharmaceutical Company do leczenia choroby Alzheimera i innych defektów poznawczych . Spotkało się to z ograniczonym sukcesem. Szwajcarska firma Santhera Pharmaceuticals zaczęła badać go pod kątem leczenia chorób nerwowo-mięśniowych . W 2010 roku wczesne badania kliniczne w leczeniu ataksji Friedreicha i dystrofii mięśniowej Duchenne'a zostały zakończone. Od grudnia 2013 roku lek nie jest dopuszczony do stosowania w tych wskazaniach w Ameryce Północnej i Europie. Został zatwierdzony przez Europejską Agencję Leków (EMA) do stosowania w dziedzicznej neuropatii nerwu wzrokowego Lebera (LHON) i został uznany za lek sierocy w 2007 roku.
Pod względem chemicznym idebenon jest związkiem organicznym z rodziny chinonów . Jest również promowany na rynku jako syntetyczny analog koenzymu Q10 ( ) CoQ10 .
Używa
Wskazania, które są lub zostały zatwierdzone na niektórych terytoriach
Efekty nootropowe i choroba Alzheimera
Idebenon poprawił uczenie się i pamięć w eksperymentach na myszach. U ludzi ocena zastępczych punktów końcowych, takich jak elektroretinografia , słuchowe potencjały wywołane i wizualne skale analogowe , również sugerowała pozytywne efekty nootropowe , ale brakuje większych badań z twardymi punktami końcowymi.
Badania nad idebenonem jako potencjalną terapią choroby Alzheimera były niespójne, ale może istnieć tendencja do niewielkich korzyści. W maju 1998 r. w Japonii anulowano zatwierdzenie tego wskazania ze względu na brak udowodnionych efektów. W niektórych krajach europejskich lek jest dostępny do leczenia indywidualnych pacjentów w szczególnych przypadkach.
Ataksja Friedreicha (Sovrima)
Wstępne testy przeprowadzono na ludziach i stwierdzono, że idebenon jest bezpiecznym lekiem na ataksję Friedreicha (FA), wykazując pozytywny wpływ na przerost mięśnia sercowego i funkcje neurologiczne. Ta ostatnia uległa znacznej poprawie tylko u młodych pacjentów. W innym eksperymencie, rocznym teście na ośmiu pacjentach, idebenon zmniejszył tempo pogorszenia funkcji serca, ale bez zatrzymywania postępu ataksji .
Lek został dopuszczony do FA w Kanadzie w 2008 roku na warunkach obejmujących dowód skuteczności w dalszych badaniach klinicznych. Jednak 27 lutego 2013 r. Health Canada ogłosiło, że idebenon zostanie dobrowolnie wycofany z dniem 30 kwietnia 2013 r. Przez jego kanadyjskiego producenta, firmę Santhera Pharmaceuticals, z powodu niewykazania skuteczności leku w dalszych badaniach klinicznych, które zostały przeprowadzone. W 2008 roku Europejska Agencja Leków (EMA) odmówiła pozwolenia na dopuszczenie do obrotu dla tego wskazania. Od 2013 roku lek nie został zatwierdzony do FA w Europie ani w USA, gdzie nie ma zatwierdzonego leczenia.
dziedziczna neuropatia nerwu wzrokowego Lebera (Raxone)
Dziedziczna neuropatia nerwu wzrokowego Lebera (LHON) to mitochondrialnie dziedziczona (matka całego potomstwa) degeneracja komórek zwojowych siatkówki (RGC) i ich aksonów, która prowadzi do ostrej lub podostrej utraty widzenia centralnego; dotyczy to głównie młodych dorosłych mężczyzn. Santhera zakończyła badanie kliniczne III fazy w tym wskazaniu w Europie z pozytywnym wynikiem iw lipcu 2011 roku złożyła wniosek o wprowadzenie leku do obrotu do europejskich organów regulacyjnych. Został zatwierdzony przez EMA dla tego wskazania i został uznany za lek sierocy w 2007 roku .
Trwa badanie wskazań
Dystrofia mięśniowa Duchenne'a (Catena)
Po eksperymentach na myszach i wstępnych badaniach na ludziach, idebenon wszedł do II fazy badań klinicznych w 2005 roku i III fazy w 2009 roku.
Inne choroby nerwowo-mięśniowe
badanie kliniczne fazy I i II dotyczące leczenia MELAS (encefalomiopatii mitochondrialnej, kwasicy mleczanowej i epizodów udaropodobnych). Badanie fazy I/II dotyczące pierwotnie postępującego stwardnienia rozsianego wykazało, że idebenon nie hamuje postępu niepełnosprawności.
Od 2022 r. Trwa badanie kliniczne III fazy dotyczące leczenia choroby Parkinsona .
Styl życia
Uważa się, że idebenon ma właściwości podobne do CoQ 10 w swoich właściwościach przeciwutleniających i dlatego był stosowany w przeciwdziałaniu starzeniu się na podstawie teorii wolnych rodników . Brakuje dowodów klinicznych na to zastosowanie. Stosowano go miejscowo w leczeniu zmarszczek .
Farmakologia
W modelach komórkowych i tkankowych idebenon działa jako transporter w łańcuchu transportu elektronów w mitochondriach i tym samym zwiększa produkcję trifosforanu adenozyny (ATP), który jest głównym źródłem energii dla komórek, a także hamuje powstawanie liponadtlenku . Pozytywny wpływ na gospodarkę energetyczną mitochondriów zaobserwowano również w modelach zwierzęcych. Znaczenie kliniczne tych wyników nie zostało ustalone.
Farmakokinetyka
Idebenon jest dobrze wchłaniany z jelit, ale podlega nadmiernemu metabolizmowi pierwszego przejścia w wątrobie, tak że mniej niż 1% dociera do krążenia. Szybkość tę można poprawić stosując specjalne preparaty ( zawiesiny ) idebenonu oraz podając go razem z tłustym pokarmem; ale nawet biorąc pod uwagę te środki, biodostępność nadal wydaje się być znacznie mniejsza niż 14% u ludzi. Ponad 99% krążącego leku wiąże się z białkami osocza . Metabolity idebenonu obejmują glukuronidy i siarczany , które są głównie (~80%) wydalane z moczem.