Inhibitor kinazy tyrozynowej Bcr-Abl
Inhibitory kinazy tyrozynowej Bcr-Abl ( TKI ) są terapią pierwszego rzutu dla większości pacjentów z przewlekłą białaczką szpikową (CML). Ponad 90% przypadków CML jest spowodowanych aberracją chromosomalną, w wyniku której powstaje tak zwany chromosom Philadelphia . Ta nieprawidłowość została odkryta przez Petera Nowella w 1960 roku i jest konsekwencją fuzji genu kinazy tyrozynowej Abelsona ( Abl ) na chromosomie 9 i genu klastra punktu przerwania ( Bcr ) na chromosomie 22 , w wyniku czego powstaje chimeryczny onkogen ( Bcr-Abl ) i konstytutywnie aktywna kinaza tyrozynowa Bcr-Abl, która odgrywa rolę w patogenezie CML. Opracowano związki do selektywnego hamowania kinazy tyrozynowej.
imatynibu przez amerykańską Agencję ds. Żywności i Leków (FDA) w 2001 r . nie były dostępne żadne leki zmieniające naturalną progresję CML. Stosowano jedynie leki cytotoksyczne , takie jak busulfan , hydroksymocznik lub interferon -alfa (rIFN-α). Chociaż pierwszy inhibitor Bcr-Abl TK został nazwany przez magazyn Time „magiczną kulą” do leczenia raka , później opracowano drugą generację Bcr-Abl TKI w celu zwalczania początkowej odporności , która się pojawiła.
Mogą pojawić się nowe formy oporności, takie jak: mutacje zmiany sensu w domenie kinazy Abl , nadekspresja Bcr-Abl, zwiększona produkcja transbłonowych białek osocza lub konstytutywna aktywacja dalszych cząsteczek sygnałowych, takich jak kinazy z rodziny Src . [ potrzebne źródło ]
Historia
CML ma dobrze określony cel molekularny i stosunkowo selektywne terapie ukierunkowane na ten cel, co nie ma miejsca w przypadku większości współczesnych nowotworów i chemioterapii . Bcr-Abl uznano za wysoce atrakcyjny cel interwencji lekowej, ponieważ gen fuzyjny Bcr-Abl koduje konstytutywnie aktywowaną kinazę. Odkrycie leku ukierunkowanego specyficznie na miejsce wiązania ATP pojedynczej kinazy uznano za dość trudne zadanie, ponieważ w ludzkim genomie znane były setki kinaz białkowych . W obecności TKI blokowane jest wiązanie ATP, fosforylacja zapobiega się, a komórki wykazujące ekspresję Bcr-Abl mają selektywną wadę wzrostu lub ulegają apoptotycznej śmierci komórkowej.
W związku z narastającą opornością i nietolerancją imatynibu podjęto wysiłki w celu opracowania nowych leków, które mogłyby hamować kinazę tyrozynową Bcr-Abl. Doprowadziło to do odkrycia leków drugiej generacji. Podczas gdy do opracowania imatynibu zastosowano badania przesiewowe leków, opracowano TKI drugiej generacji z racjonalnym podejściem do projektowania leków ze względu na zwiększoną wiedzę z zakresu biologii strukturalnej kinazy tyrozynowej Bcr-Abl.
Pierwsza generacja
Imatinib (STI571)
Imatinib (Gleevec) został odkryty w 1992 roku i jest uważany za lek pierwszej generacji, ponieważ jest pierwszym inhibitorem kinazy tyrozynowej Bcr-Abl stosowanym w leczeniu CML.
Rozwój
W rozwoju imatynibu struktura kinazy tyrozynowej Bcr-Abl odegrała ograniczoną rolę, ponieważ była nieznana. W Novartis przeprowadzono wysokowydajne badanie przesiewowe bibliotek chemicznych w celu zidentyfikowania cząsteczki wyjściowej, którą nazwano „ pirymidyną A ” . Związek ten służył jako związek wiodący , a następnie został przetestowany i zmodyfikowany w celu uzyskania imatynibu. Wraz z zastąpieniem imidazolowej grupą benzamidową specyficzność związku wzrosła, natomiast jego aktywność jako inhibitor kinazy pozostał taki sam. Następnie wprowadzenie podstawnika metylowego orto do grupy pirymidynylo-aminowej zwiększyło siłę działania .
Wiążący
Od tego czasu badania krystalograficzne wykazały, że imatynib wiąże się z domeną kinazy Abl tylko wtedy, gdy domena przyjmuje konformację nieaktywną lub „zamkniętą”. W tym miejscu bogata w glicynę pętla fosforanowa wiążąca P (pętla P) składa się nad miejscem wiązania ATP , a pętla aktywacyjna przyjmuje konformację, w której zamyka miejsce wiązania substratu i rozrywa miejsce wiązania fosforanu ATP, aby zablokować aktywność katalityczną enzymu. Przesunięcie triady Asp Phe Gly (DFG) na N-końcu pętli aktywacji powoduje odsłonięcie kieszeni wiążącej, która może być wykorzystana przez inhibitory. Ta konformacja jest określana jako DFGout .
Imatinib wiąże się z domeną Abl poprzez sześć interakcji wiązań wodorowych . To stabilizuje imatynibu Bcr-Abl i zapobiega dotarciu ATP do jego miejsca wiązania. Wiązania wodorowe obejmują pirydynę -N i szkielet -NH Met -318, aminopirymidynę i hydroksyl łańcucha bocznego Thr -315 , amid - NH i karboksylan łańcucha bocznego Glu -286 , karbonyl i szkielet -NH Asp -381, protonowana metylopiperazyna ze szkieletowymi atomami karbonylowymi Ile -360 i His -361. Ponadto do wiązania przyczynia się szereg interakcji van der Waalsa . Hydrofobowa kieszeń jest utworzona przez reszty aminokwasowe Ile-293, Leu -298, Leu-354 i Val -379 wokół pierścienia fenylowego sąsiadującego z grupą piperazynylo -metylową imatynibu. W momencie jego odkrycia, wobec braku informacji strukturalnych, nie można było znaleźć jasnego wyjaśnienia imponującej selektywności imatynibu.
Chociaż leczenie pierwszej generacji osiągnęło niezwykle wysoki odsetek odpowiedzi i niski wskaźnik nawrotów u pacjentów z CML, niektórzy pacjenci doświadczają oporności lub nietolerancji na imatynib.
Lekooporność
Lekooporność jest głównym motorem ciągłych badań i rozwoju Bcr-Abl TKI. Wkrótce po wprowadzeniu imatynibu badacze zaczęli opisywać szereg linii komórkowych pochodzących z badań in vitro z opornością na ten lek. Wkrótce po tym nastąpił kliniczny opis komórek opornych na imatynib u pacjentów, co zaowocowało wysiłkami mającymi na celu lepsze zrozumienie biologii stojącej za tymi obserwacjami. Oceny odpowiedzi terapeutycznej imatynibu u pacjentów z CML opierają się na spełnieniu kryteriów hematologicznych , cytogennych i molekularnych kamienie milowe. Pacjenci, którzy nie osiągają określonych odpowiedzi w określonych punktach czasowych, są opisywani jako pierwotnie oporni na terapię, a ci, którzy tracą wcześniej uzyskane kamienie milowe w regresji choroby, są określani jako oporni wtórnie. Przed wyciągnięciem wniosków należy wziąć pod uwagę, że retrospektywne wykazały dużą częstość przypadków nieprzestrzegania zaleceń dotyczących imatynibu u pacjentów z CML, co może prowadzić do niepożądanych wyników klinicznych.
Ogólnie oporność na imatynib można podzielić na mechanizmy zależne i niezależne od Bcr-Abl. Mechanizmy zależne od Bcr-Abl obejmują nadekspresję lub amplifikację genu Bcr-Abl i mutacje punktowe w domenie kinazy Bcr-Abl, które zakłócają wiązanie imatynibu. Mechanizmy niezależne od Bcr-Abl obejmują czynniki wpływające na stężenie imatynibu w komórce, na przykład poprzez zmiany w napływie i wypływie leku oraz aktywację niezależnych szlaków Bcr-Abl, takich jak członkowie rodziny kinaz Src. Oporność na imatynib może być również wytwarzana przez inne mechanizmy, które nie zostaną tutaj wymienione, ponieważ znaczenie tych mechanizmów pozostaje nadal kwestią otwartą ze względu na brak danych klinicznych.
Mechanizmy oporności zależne od Bcr-Abl
Duplikacja Bcr-Abl
Pierwsze doniesienia o oporności na imatynib opisywały rozwój amplifikacji onkogenu . Oznacza to, że gen kodujący patogenną kinazę tyrozynową Bcr-Abl jest zduplikowany w sekwencji DNA , co prowadzi do wyższej ekspresji patogenu. Zwiększenie dawki imatynibu mogłoby przezwyciężyć ten rodzaj oporności, pod warunkiem, że nie wystąpią poważne lub nie do zniesienia działania niepożądane .
Mutacja Bcr-Abl
Mutacje punktowe mogą powodować substytucje aminokwasów w domenie kinazy białka Bcr-Abl i zakłócać miejsce wiązania imatynibu na kinazie tyrozynowej, powodując utratę wrażliwości na lek. Mutacje te zwykle wpływają na strukturę białka Bcr-Abl, prowadząc albo do przerwania krytycznych punktów kontaktowych między lekiem a białkiem Bcr-Abl, albo do indukcji zmiany konformacyjnej, w wyniku czego powstaje białko, z którym imatynib nie jest w stanie się związać.
postępem choroby, CML , od fazy przewlekłej do fazy blastycznej . Najważniejszymi mutacjami są pętli P i mutacja T315I. Opisano również mutacje w innych miejscach kinazy, na przykład w C- helisie , domenie SH2 , miejscu wiązania substratu, pętli aktywacyjnej i płacie C-końcowym . Niektóre z tych mutacji mają znaczenie kliniczne, ale żadne z nich nie ma takiego znaczenia jak pętli P i T315I.
Mutacja T315I
T315I jest wyjątkową mutacją ze względu na swoją oporność na wszystkie zatwierdzone inhibitory Bcr-Abl przed ponatynibem . Jest to spowodowane zamianą pojedynczej pary zasad cytozyny na tyminę (C -> T) w pozycji 944 sekwencji genu Abl ( kodon „315” białka Abl), w wyniku czego aminokwas T -hreonina zostaje zastąpiony przez I -soleucynę w tej pozycji - stąd 'T315I'. To podstawienie eliminuje krytyczną tlenu potrzebną do wiązanie wodorowe między imatynibem a kinazą Abl, a także tworzy przeszkodę przestrzenną dla wiązania większości TKI. Po odkryciu oszacowano, że co 6 z 9 przypadków CML w zaawansowanym stadium z opornością na imatynib było nosicielami tej mutacji. T315I powoduje największą oporność ze wszystkich mutacji zarówno na imatynib, jak i TKI drugiej generacji. Ponatinib (Iclusig) firmy Ariad został zatwierdzony w 2013 r. do stosowania jako leczenie drugiego rzutu CML i jest jedynym licencjonowanym TKI, który skutecznie wiąże się ze zmutowaną kinazą T315I.
Mutacje pętli P
Struktura Bcr-Abl zawiera dwie elastyczne pętle, pętlę P wiążącą ATP i pętlę aktywacyjną. Pętle te mają określone układy w nieaktywnej konformacji Bcr-Abl, które stabilizują konformację podstawową. Mutacje w tych pętlach destabilizują układ pętli w taki sposób, że domena kinazy nie może przyjąć nieaktywnej konformacji wymaganej do wiązania imatynibu. Najczęstsze są mutacje w regionie pętli P, stanowiące 36-48% wszystkich mutacji. Istnieją dane kliniczne wskazujące, że mutacje Bcr-Abl w pętli P są 70-100 razy mniej wrażliwe na imatynib w porównaniu z natywnym Bcr-Abl.
Bcr-Abl Niezależne mechanizmy oporności
Postulowano dodatkowe mechanizmy opisujące oporność obserwowaną w różnych systemach modelowych, chociaż żaden nie został wyraźnie zidentyfikowany jako jedyne źródło oporności klinicznej.
Wypływ leków spowodowany przez P-glikoproteiny
Niektóre badania na liniach komórkowych wykazały, że oporność na imatynib może być częściowo spowodowana wzrostem ekspresji pompy usuwającej glikoproteinę P. W niektórych przypadkach przywrócono wrażliwość na imatynib dzięki zastosowaniu środków hamujących aktywność P-glikoproteiny.
Import leków transporterem kationów organicznych 1
Wnikanie imatynibu do komórek zależy od transportera kationów organicznych ( OCT1 ). OCT1 odgrywa znaczącą rolę w oporności na imatynib, hamując jego napływ, a tym samym zmniejszając wewnątrzkomórkową biodostępność imatynibu. Pacjenci z niską ekspresją, aktywnością lub polimorfizmem OCT1 mieli znacząco niższe wewnątrzkomórkowe poziomy imatynibu. Odpowiedź pacjentów z niską aktywnością OCT1 była istotnie zależna od dawki. Dane te wskazują, że aktywność OCT1 jest ważnym wyznacznikiem odpowiedzi molekularnej na imatynib.
Aktywacja alternatywnego szlaku sygnałowego
W kilku grupach pacjentów oporność może być spowodowana aktywacją innych szlaków sygnałowych, zwłaszcza kinaz z rodziny Src. Kinazy z rodziny Src są zaangażowane w sygnalizację Bcr-Abl i pośredniczą w oporności na imatynib poprzez stabilizację aktywnej konformacji Bcr-Abl, konformacji, która nie wiąże imatinibu. Ponadto coraz więcej dowodów sugeruje, że kinazy z rodziny Src są również zaangażowane w niezależne od Bcr-Abl formy oporności na imatynib.
Rozwiązania
Możliwości leczenia pacjentów z CML opornych lub nietolerujących imatynibu mogą obejmować takie strategie, jak zwiększanie dawki imatynibu lub stosowanie leków drugiej generacji. Wykazano, że zwiększanie dawek imatynibu przezwycięża niektóre przypadki pierwotnej oporności na imatynib, takie jak duplikacja Bcr-Abl, ale odpowiedź jest zwykle krótkotrwała. W przypadku oporności lub nietolerancji pomocne może być zbadanie mutacji Bcr-Abl w celu ukierunkowania wyboru leczenia drugiego rzutu, ponieważ zmienne opcje mają inny profil funkcji w stosunku do różnych mechanizmów oporności. Leki drugiej generacji oferują lepszą potencję i większe prawdopodobieństwo sukcesu u opornych pacjentów. Istnieje również rosnące zainteresowanie testowaniem hipotezy , że podawanie wielu inhibitorów kinazy Abl pacjentom we wczesnej fazie może być stosowane do opóźniania lub zapobiegania pojawianiu się klonów lekoopornych . Połączenie dwóch środków ukierunkowanych na różne szlaki zaangażowane w CML może znacznie poprawić wskaźniki odpowiedzi i potencjalnie zwiększyć przeżycie.
Leki drugiej generacji
Leki drugiej generacji mają mieć mniejszą oporność i nietolerancję niż imatynib. Obecnie dostępne na rynku leki drugiej generacji to nilotynib, dazatynib, bosutynib i ponatynib.
Nilotynib (AMN107)
Rozwój
Nilotynib jest pochodną fenyloamino-pirymidyny, która jest strukturalnie podobna do imatynibu. Został opracowany w oparciu o strukturę kompleksu Abl-imatynib, aby zaspokoić potrzebę związaną z nietolerancją i opornością na imatynib. W cząsteczce imatynibu dokonano niewielkich zmian, aby uczynić go silniejszym i selektywnym jako inhibitor Bcr-Abl, a zmiany te doprowadziły do odkrycia nilotynibu. Nilotynib jest selektywnym inhibitorem kinazy Bcr-Abl.
Nilotynib jest 10-30 razy silniejszy niż imatynib w hamowaniu aktywności kinazy tyrozynowej Bcr-Abl i proliferacji komórek wykazujących ekspresję Bcr-Abl. Lek skutecznie hamuje autofosforylację Bcr-Abl na Tyr -177, która bierze udział w patogenezie CML. synergiczny zgłaszano aktywność imatynibu i nilotynibu po ich jednoczesnym podaniu. Może to wynikać z faktu, że leki są wychwytywane w komórkach przez różne mechanizmy: napływ imatynibu zależy od OCT1, ale nilotynib nie. Nilotynib nie jest również substratem dla pompy P-glikoproteiny transportera wypływu, w przeciwieństwie do imatynibu. Chociaż dwuwymiarowe struktury molekularne tych dwóch leków mogą wyglądać podobnie, różnią się one pod względem struktury przestrzennej i właściwości molekularnych.

Wiążący
Nilotynib wiąże się z nieaktywną konformacją domeny kinazy Abl, głównie poprzez interakcje lipofilowe , a tym samym blokuje jego aktywność katalityczną. Nilotynib wiąże się z domeną kinazy, tworząc cztery interakcje wiązań wodorowych obejmujące pirydyl -N i szkielet NH Met-318, anilino -NH i łańcuch boczny OH Thr-315, amido-NH i karboksylan łańcucha bocznego Glu-286 i amidokarbonyl ze szkieletem NH Asp-381. Segment [4-(3-pirydynylo)-2-pirymidynylo]anilinowy nilotynibu ma bliskie interakcje wiązania z resztami Met-318, Phe-317 i Thr-315 regionu w miejscu wiązania ATP. Pozostała połowa związku rozciąga się poza pozostałość strażnika Thr-315, wiążąc się w dodatkowej kieszeni. Grupy 3-metyloimidazolowe i trifluorometylowe nilotynibu wchodzą w ważne interakcje z domeną kinazy Abl. Grupy te powodują również, że kształt nilotynibu bardzo różni się od kształtu imatynibu. Nilotynib wiąże się również z kinazą poprzez dużą liczbę słabych oddziaływań van der Waalsa.
Opór
Nilotynib wykazał działanie przeciwko większości mutacji (32/33), które są związane z opornością na imatynib, ale mutant T315I pozostaje oporny na nilotynib. Jego nieskuteczność wobec mutanta T315I wydaje się być konsekwencją utraty oddziaływania wiązania H między treoniną-O i aniliną-NH na nilotynibie oraz starcia sterycznego między grupą izoleucyny-metylową a grupą 2-metylofenylofenylową nilotynibu. Z drugiej strony oporność na nilotynib jest związana z ograniczonym spektrum mutacji kinazy Bcr-Abl, które dotyczą głównie pętli P i T315I. Jednak wszystkie mutacje z wyjątkiem T315I zostały skutecznie stłumione przez zwiększenie stężenia nilotynibu. Chociaż nilotynib jest silniejszy niż imatynib, możliwe jest, że jego specyficzny sposób wiązania z Abl może sprawić, że inne miejsca będą podatne na nowe rodzaje lekooporności.
Dazatynib (BMS-354825)
Rozwój
Dazatynib jest tiazoliloaminopirymidyną opracowaną w postaci chlorowodorku . Odkryto go za pomocą programu ukierunkowanego na leki immunosupresyjne i jest on 325-krotnie silniejszy przeciwko komórkom wykazującym ekspresję Bcr-Abl typu dzikiego niż imatynib. Dazatynib jest wielokierunkowym inhibitorem kinaz z rodziny Bcr-Abl i Src. Ma również działanie hamujące na dodatkowe kinazy w dół.

Wiążący
Dazatynib wiąże się z Abl przy mniej rygorystycznych wymaganiach konformacyjnych niż imatynib, więc wykazuje zwiększoną siłę działania, ale mniejszą selektywność w porównaniu z imatynibem. Dazatynib wiąże zarówno aktywną, jak i nieaktywną konformację kinazy Abl, w przeciwieństwie do większości innych TKI, które wiążą się tylko z postacią aktywną. Zidentyfikowano związki ukierunkowane na aktywną konformację, ale miejsce wiązania we wszystkich setkach ludzkich kinaz białkowych jest bardzo podobne. Dlatego istnieje znacznie większy zakres różnic między nieaktywnymi konformacjami, więc wysiłki mające na celu odkrycie wysoce selektywnych inhibitorów kinaz są skierowane na cząsteczki, które wiążą się z nieaktywną konformacją.
Dazatynib ma pewne elementy strukturalne wspólne z nilotynibem, w szczególności zestawienie grup aminopirymidynowych i karboksyamidowych . Segment aminotiazolowy dasatynibu tworzy dwukleszczowe oddziaływanie wiązaniami H ze szkieletem CO i NH Met-318, a amid-NH tworzy wiązanie H z tlenem łańcucha bocznego Thr-315.
Opór
Ponieważ dazatynib jest inhibitorem kinaz z rodziny Src, może przezwyciężyć oporność na skutek aktywacji kinazy z rodziny Src. Ponieważ nie wiąże się z Bcr-Abl z takimi samymi rygorystycznymi wymaganiami konformacyjnymi jak imatynib, może hamować wszystkie mutanty domeny kinazy Bcr-Abl z wyjątkiem T315I. Dazatynib nie jest również substratem pomp wypływowych wielolekowej glikoproteiny P, takich jak imatynib. Z tego powodu dazatynib może być aktywny u niektórych pacjentów po niepowodzeniu leczenia zarówno imatynibem, jak i nilotynibem. Chociaż dazatynib jest znacznie silniejszy niż imatynib, możliwe jest, podobnie jak w przypadku nilotynibu, że jego specyficzny sposób wiązania z Abl może prowadzić do nowych wrażliwych miejsc, które mogą nadawać nowe rodzaje lekooporności. Mutacje zostały znalezione na Phe317, więc jest to potencjalnie wrażliwe miejsce dla tego leku.
Bosutynib (SKI-606)
Rozwój
Struktura bosutynibu jest oparta na rusztowaniu chinolinowym i jest strukturalnie podobna do matrycy chinazolinowej AstraZeneca . Badania przesiewowe drożdży zależne od kinazy Src doprowadziły do scharakteryzowania karbonitrylu 4-anilino-3-chinoliny jako inhibitora Src. Połączenie cech tego hitu i związku pokrewnego oraz przyłączenie solubilizujących doprowadziło do odkrycia bosutynibu. Zasugerowano, że jest inhibitorem kinazy Abl i po przetestowaniu jako taki okazał się nieco silniejszy przeciwko Abl niż Src ( IC50 1,4 nM w porównaniu z 3,5 nM ). Aktywność bosutynibu została po raz pierwszy opisana w 2001 roku, a jako inhibitor kinazy Abl została ujawniona w 2003 roku. Początkowo sądzono, że bosutynib jest selektywnym inhibitorem kinazy Src, ale obecnie wiadomo, że profil hamowania kinazy jest znacznie mniej ograniczony, niż pierwotnie sądzono. Bosutynib hamuje Src, Abl i szeroki zakres kinaz tyrozynowych i serynowo-treoninowych.
Opór
Bosutynib hamował komórki wykazujące ekspresję różnych mutacji, z których niektóre prowadziły do oporności na imatynib, ale mutacja T315 była całkowicie oporna na bosutynib. W przeciwieństwie do imatynibu, nilotynibu i dazatynibu, bosutynib nie jest skutecznym substratem dla transporterów oporności wielolekowej (MDR) , które promują wypływ obcych cząsteczek z komórek. Bosutynib hamuje nawet te białka transportowe w wyższych stężeniach.
Ponatynib (AP24534)
Firma ARIAD Pharmaceuticals , Inc. ogłosiła 10 września 2010 r., że ponatynib , aktywny po podaniu doustnym TKI Bcr-Abl, skuteczny przeciwko mutacji T315I, został dopuszczony do badania klinicznego fazy II.
Droga do odkrycia może być powiązana z AP23464, jednym z pierwszych konkurencyjnych podwójnych inhibitorów Src/Abl firmy Ariad. AP23464 został zidentyfikowany przy użyciu projektowania leków na bazie struktury i skoncentrowanych bibliotek syntetycznych trójpodstawionych puryn . Substancja silnie hamuje, w skali nanomolowej, kinazy Src i Bcr-Abl, w tym wiele powszechnych mutacji Bcr-Abl opornych na imatynib. AP23464 nie hamuje jednak mutacji T315I, podczas gdy AP24534 (ponatynib) tak.
Rozwój
Ariad użył bardzo silnego wiodącego leku, AP23464, do dalszego zbadania możliwości hamowania matryc z rdzeniem purynowym dla podwójnych inhibitorów Src/Abl. Po pierwsze, szukając substancji działających na nieaktywną konformację Abl, łańcuch boczny związany z atomem azotu na rdzeniu purynowym został zastąpiony strukturą diaryloamidową, o której wiadomo, że ma wysokie powinowactwo do nieaktywnej konformacji poprzez tworzenie kluczowych wiązań wodorowych i wypełnianie hydrofobowych kieszeni na kinazie. Ponadto ustalono, że cyklopentyl grupa na rdzeniu purynowym zderzyła się z bogatą w glicynę pętlą P w tym potwierdzeniu i została w ten sposób usunięta z cząsteczki. Następnie, w testach in vitro na aktywność hamującą i testach wchłaniania doustnego in vivo, bardziej lipofilowy, związany z amidem, cyklopropyl Stwierdzono, że grupa na C6 na rdzeniu purynowym wykazuje zarówno zadowalającą farmakokinetykę, jak i skuteczność. Wreszcie modyfikacje łańcucha bocznego diaryloamidu poprzez dodanie wyrostków imidazolowych zostały zainspirowane nowo uwolnioną wówczas strukturą nilotynibu. Te modyfikacje zaowocowały czymś, co nazwano AP24163. Podczas tego cyklu rozwojowego Ariad przetestował kilka substancji przeciwko komórkom transfekowanym zmutowaną kinazą Bcr-Abl T315I i, co zaskakujące, stwierdził, że AP24163 wykazuje rozsądne działanie hamujące oprócz silnego hamowania natywnego Bcr-Abl.
Kontynuując ten przełom, firma Ariad rozpoczęła dalsze badania mające na celu zwiększenie skuteczności związku AP24163 przeciwko mutacji T315I. Dokowanie cząsteczki do miejsca wiązania ATP zmutowanej kinazy Bcr-Abl T315I ujawniło, że oczekiwane zderzenie steryczne z izoleucyną nie było obecne ze względu na mniej wymagające przestrzennie wiązanie winylowe między rdzeniem purynowym a łańcuchem bocznym diaryloamidu w porównaniu z innymi TKI. Pierwszym krokiem była próba znalezienia jeszcze mniej wymagającej sterycznie struktury. Najpierw acetylen przetestowano powiązanie, które skutkowało wyższą siłą działania, ale niekorzystną farmakokinetyką. Później wybrano bardziej stabilne wiązanie 2-butynowe . Aby osiągnąć to połączenie, rdzeń imidazolo[1,2-a]pirydynowy został użyty jako materiał wyjściowy dla Sonogashira reakcja; ale farmakokinetyka była nadal słaba. Podczas opracowywania AP24163 dodanie bocznego łańcucha cyklopropanu na C8 w rdzeniu purynowym zaowocowało korzystną farmakokinetyką. Następnie przetestowano kilka różnych łańcuchów bocznych, ale najlepsze wyniki uzyskano bez żadnego łańcucha bocznego, w wyniku czego otrzymano substancję o zadowalającej farmakokinetyce, ale teraz o zmniejszonej sile działania również przeciwko T315I. Pierwszym krokiem do ponownego zwiększenia mocy było przyjrzenie się innym TKI. Imatynib ma końcową grupę metylopiperazynową, która, jak wykazano, tworzy wiązanie wodorowe z karbonylowym atomem tlenu reszty Ile-360 w pętli aktywacyjnej kinazy Abl. Pierścień piperazynowy jest również powszechną grupą solubilizującą, która może jeszcze bardziej poprawić właściwości farmakokinetyczne cząsteczki. Te spekulacje potwierdził dwukrotny wzrost działania hamującego wobec zmutowanej kinazy Bcr-Abl T315I, Wydaje się, że wiązanie substancji (o nazwie „19a”) z białkami osocza zmniejszyło się, co pozwala na stosowanie mniejszych dawek o tej samej sile działania. Chociaż „19a” wykazywał dobrą farmakokinetykę po podaniu doustnym zarówno u myszy, jak i szczurów, zachował również wysoki współczynnik podziału na poziomie 6,69. Tak więc, próbując jeszcze bardziej zmniejszyć lipofilowość cząsteczki, dokonano podstawienia pojedynczego atomu węgla na rdzeniu imidazo[1,2-a]pirydyny; co zaowocowało tak zwanym związkiem ponatynibem .
Wiążący
Rentgenowska analiza krystalograficzna ponatynibu i zmutowanej kinazy T315I Bcr-Abl wykazuje, że rdzeń imidazo[1,2b] pirydazyny spoczywa w kieszeni adeninowej enzymu. Grupa metylofenylowa zajmuje hydrofobową kieszeń za I315, etynylem wiązanie tworzy korzystne interakcje van der Waalsa z aminokwasem, a grupa trifluorometylowa wiąże się z kieszenią indukowaną przez nieaktywną kinazę konformacyjną. Również w konformacji kinazy, w której spoczywa ponatynib, dodatkowe korzystne interakcje van der Waalsa między lekiem a Tyr-253 i Phe-382. Generowanych jest pięć wiązań wodorowych, ze szkieletem Met-318 w regionie zawiasowym, ze szkieletem Asp-381, z łańcuchem bocznym Glu-286 i protonowaną metylopiperazyną ze szkieletowymi atomami karbonylowymi Ile-360 i His -361.
Wykazano, że dzięki tej strukturze ponatynib ma stosunkowo szeroki profil specyficzności kinazowej, który prawdopodobnie można powiązać z liniowością części łączącej cząsteczki. Dzięki tej liniowej strukturze wydaje się, że lek unika zderzeń sterycznych z hydrofobowymi resztami strażnika TK. Pomimo tego, a nawet z tego powodu, ponatynib jest silnym lekiem i celuje nie tylko w większość znanych mutacji w Bcr-Abl TK, ale przede wszystkim w T315I. Mutacja ta pojawia się jako powszechna droga prowadząca do niepowodzenia leczenia zarówno pierwszego, jak i drugiego rzutu. W przeciwieństwie do innych opracowywanych inhibitorów ukierunkowanych na T315I, ponatynib nie jest ukierunkowany na kinazy Aurora, co wyraźnie go od nich odróżnia i podkreśla znaczenie jego odkrycia.
Bafetinib (INNO-406)
Wraz z pojawiającą się opornością na leczenie imatynibem po jego wprowadzeniu na rynek, poszukiwano alternatywnego leczenia. Bafetinib był potomkiem próby stworzenia silniejszego leku niż imatynib, skutecznego przeciwko różnym mutacjom punktowym w kinazie Bcr-Abl, z mniejszą liczbą działań niepożądanych i z węższym widmem kinazy, a mianowicie tylko Lyn i Bcr-Abl.
Rozwój
W poszukiwaniu substancji spełniającej wymienione kryteria zbadano strukturę krystaliczną imatynibu związanego z Abl. To ujawniło hydrofobową kieszonkę wokół pierścienia fenylowego sąsiadującego z grupą piperazynylometylową imatynibu. Próby wykorzystania tej kieszeni w celu zwiększenia skuteczności doprowadziły do dodania różnych grup hydrofobowych, w tym pojedynczego fluoru , bromu i chloru podstawniki. Ostatecznie stwierdzono, że grupa trifluorometylowa w pozycji 3 daje najlepsze wyniki, z około 36-krotną poprawą w porównaniu z imatynibem. Teraz trzeba było przeciwdziałać dodaniu grupy hydrofobowej, aby utrzymać rozpuszczalność substancji. Bliższe badanie struktury krystalicznej kompleksu imatinib-kinaza ujawniło, że Tyr-236 znajdował się blisko pierścienia pirydynowego imatynibu, co sugeruje, że było tam niewiele miejsca lub nie było go wcale dla większej grupy. Mając to na uwadze, bardziej hydrofilowy Pierścień pirymidynowy został zastąpiony pirydyną, co, jak stwierdzono, zwiększa rozpuszczalność, pozostawiając skuteczność taką samą lub nawet nieco wyższą. Ostatecznie, aby poprawić wiązanie wodorowe pierścienia piperazyny imatynibu z Ile-360 i His-361, wprowadzono pochodne pirolidyny i azetydyny. Najbardziej obiecująca substancja z tych końcowych modyfikacji została oznaczona jako NS-187.
Wiążący
Ze względu na podobieństwa strukturalne imatynibu i bafetynibu, ich wiązanie z Bcr-Abl jest również dość podobne. Jedyna zauważalna różnica wynika z hydrofobowej interakcji między grupą trifluorometylową a hydrofobową kieszenią utworzoną przez Ile-293, Leu-298, Leu-354 i Val-379. Tę grupę można również powiązać ze specyficznością bafetynibu dla Lyn, ponieważ miejsce wiązania jest tam prawie identyczne jak na Bcr-Abl.
Bafetinib ma swoje miejsce w terapii TKI, ponieważ jest skuteczny zarówno wobec większości mutacji opornych na imatynib (z wyłączeniem T315I), jak i niektórych mutacji opornych na dazatynib. Bafetinib ma również większe powinowactwo do Bcr-Abl niż nilotynib (ale mniej niż dasatinib), ale celuje tylko w kinazy z rodziny Bcr-Abl i Src Lck i Lyn; z niezrównaną specyficznością, co sugeruje prawdopodobieństwo wystąpienia mniej działań niepożądanych.
CytRx ma bafetinib w badaniu klinicznym II fazy jako lek na białaczkę od maja 2010 r.
Pochodne 1,3,4 tiadiazolu - Substancja 14
Pewne zainteresowanie wzbudziły pochodne tiazolu i tiadiazolu oraz ich zdolność do hamowania Bcr-Abl TK.
Rozwój
Jedna z włoskich grup badawczych odkryła poprzez cyfrowe badania przesiewowe, że dostępne w handlu pochodne tiadiazolu wykazują umiarkowane działanie hamujące zarówno na kinazy Abl, jak i Src. Używając rdzenia 1,3,4 tiadiazolu i wypróbowując różne grupy lub cząsteczki na pierścieniach benzenowych, wyprodukowano kilka różnych substancji o właściwościach hamujących. Elastyczność rdzenia pozwoliła wielu konformacjom substancji związać się z miejscem ATP kinazy Abl, chociaż wszystkie z nich związały się z aktywną formą kinazy. Dalsze badania wiązania wykazały, że pozycja siarki, która wiąże się ze strukturą toluenu, odgrywa ważną rolę w wiązaniu Abl, a także, że tylko jeden tiadiazol azotu tworzy wiązanie wodorowe. Ponadto komputerowa analiza struktury wykazała, że benzen-keton związany z amidem można zastąpić korzystniejszym tiofenowy . Chociaż należy zauważyć, że analiza ta została wykonana z porównaniem struktury krystalicznej Abl i dazatynibu, który jest nieaktywną konformacją Abl, wiedza zebrana podczas dokowania i analizy struktury doprowadziła do identyfikacji związku, określanego jako substancja 14, z dużym powinowactwem do Abl.
Wiążący
Wiązanie substancji 14 jest częściowo podobne do dazatynibu, segment aminotiazolowy substancji 14 tworzy dwukleszczowe oddziaływanie wiązania H ze szkieletem CO i NH Met-318, podczas gdy metoksy-benzen ładnie wpada do hydrofobowej kieszeni utworzonej przez Val 256, Ala 253, Lys 271 i Ala 380. Chociaż podobne właściwości wiążące jak dasatinib sugerują, że możliwość wytworzenia TKI Bcr-Abl z rdzeni tiazolowych jest realna, pytanie pozostaje otwarte, czy badania te doprowadzą do powstania analogu dasatinib lub nowy sposób hamowania TK.
Inni
Rebastynib (DCC-2036) Również inhibitor TIE-2 i VEGFR-2. Przeprowadzono badanie kliniczne fazy 1 dotyczące białaczek (Ph+ CML z mutacją T315I). Jest w fazie 1 badania klinicznego terapii skojarzonej raka piersi z przerzutami.
Asciminib (ABL001) jest inhibitorem kinazy Abelsona ukierunkowanej na kieszeń mirystoilową, aby allosterycznie hamować enzym. W sierpniu 2020 r. zakończył badanie fazy III dotyczące CML (ASCEMBL), wykazujące lepszą skuteczność niż bosutynib.
Streszczenie
| Lek | Struktura | wiązania H | Aminokwasy wiążące H | Wiążące potwierdzenie | Odkrycie | Stan na 2017 rok |
|---|---|---|---|---|---|---|
| Imatinib (STI571) |
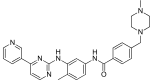
|
6 | Met-318, Thr-315, Glu-286, Asp-381, Ile-380, His-361 | Nieaktywny | Test narkotykowy | Sprzedawany jako terapia pierwszego rzutu |
| Nilotynib (AMN107) |

|
4 | Met-318, Thr-315, Glu-286, Asp-381 | Nieaktywny | Racjonalne projektowanie leków | Sprzedawany jako terapia drugiego rzutu |
| Dazatynib (BMS-345825) |

|
3 | Met-318, Thr-315 | Aktywny | Racjonalne projektowanie leków | Sprzedawany jako terapia drugiego rzutu |
| Bosutynib (SKI-606) |

|
- | - | Nieaktywny | Racjonalne projektowanie leków | Sprzedawany jako terapia drugiego rzutu |
| Ponatynib (AP-24534) |

|
5 | Met-318, Asp-381, Glu-286, His-381, Ile-380 | Nieaktywny | Racjonalne projektowanie leków | Sprzedawany jako terapia drugiego rzutu |
| Bafetinib (INNO-406) |
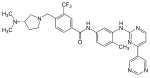
|
6 | Met-318, Thr-315, Glu-286, Asp-381, His-361, Ile-360 | Nieaktywny | Racjonalne projektowanie leków | Sprzedawany jako terapia drugiego rzutu |
Obecny stan - dot. Ph+ CML
Imatynib pozostaje standardowym TKI pierwszej linii. Nilotynib i dazatynib zostały również zatwierdzone przez FDA jako leki pierwszego rzutu odpowiednio w czerwcu i październiku 2010 r. Cztery z tych leków, nilotynib, dazatynib, bosutynib i ponatynib, są zatwierdzone do leczenia CML opornej lub nietolerującej imatynibu. Dane pierwszego rzutu dla tych związków są zachęcające i sugerują, że niektóre lub wszystkie z nich mogą w przyszłości zastąpić imatynib jako standardowy TKI pierwszej linii.







