Oksydaza L-aminokwasów
| L-aminooksydaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 L-aminokwasu oksydaza Homotetramer oksydazy L-aminokwasu, Vipera ammodytes
| |||||||||
| Identyfikatory | |||||||||
| nr WE | 1.4.3.2 | ||||||||
| nr CAS | 9000-89-9 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
W enzymologii oksydaza L-aminokwasu (LAAO) ( EC 1.4.3.2 ) jest enzymem , który katalizuje reakcję chemiczną
- L-aminokwas + H 2 O + O 2 2-oksokwas + NH 3 + H 2 O 2
Enzym został po raz pierwszy opisany w 1944 roku przez A. Zellera i A. Maritza. LAAO są nie tylko dość zmienne pod względem masy cząsteczkowej, ale także różnią się znacznie pod względem stabilności. W podobny sposób enzym ten wykonuje niezliczone czynności biologiczne, w tym apoptozy , indukcję obrzęku , krwotok oraz hamowanie lub indukcję agregacji płytek krwi .
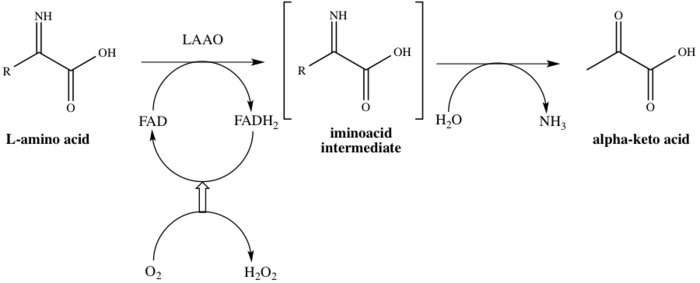
Jak sugeruje nazwa rodziny, LAAO to flawoenzymy , których funkcją jest katalizowanie stereospecyficznej deaminacji oksydacyjnej L- aminokwasu . Trzema substratami reakcji enzymatycznej są L- aminokwas , woda i tlen , podczas gdy trzema produktami są odpowiednie α- ketokwasy (2-oksokwasy), amoniak i nadtlenek wodoru . Jeden przykład działania enzymu występuje podczas konwersji L-alanina do kwasu pirogronowego (kwas 2-oksopropionowy), jak pokazano na rysunku 1.
Obfitość
Jad węża
Chociaż LAAO są obecne w różnych organizmach eukariotycznych i prokariotycznych, jad węża jest szczególnie bogatym źródłem enzymu i proponuje się, aby LAAO zapewniały toksyczne efekty po zatruciu. LAAO, które zostały oczyszczone z jadów różnych gatunków węży, okazały się najlepszymi kandydatami do badania tej nowej rodziny enzymów. Viperidae , Crotalidae i Elapidae , stwierdzono, że jad węża-LAAO (sv-LAAO) stanowi około 1-9% całkowitej ilości białka.
Struktura
Większość sv-LAAO jest opisywana jako homodimery z wieloma podjednostkami, które mają masę cząsteczkową około 50–70 kDa, a interakcja między podjednostkami zachodzi poprzez interakcje niekowalencyjne . Sv-LAAO są obecne w kwaśnych, zasadowych i obojętnych formach białka. Badania, które dotyczą rentgenowskich struktur kryształów, potwierdziły, że sv-LAAO często występują jako funkcjonalne dimery, przy czym każdy dimer ma trzy domeny. Te trzy domeny są miejscem wiązania substratu , miejsce wiązania FAD i domena helikalna. Określono, że miejsce wiązania substratu enzymu znajduje się u podstawy długiego lejka, który rozciąga się na 25 Å od powierzchni do wnętrza białka. Ustalono również, że grupa prostetyczna FAD zostaje głęboko zakorzeniona w strukturze enzymu, co pozwala na wszechobecne interakcje zarówno z sąsiednimi atomami, jak i konserwatywnymi cząsteczkami wody. Dodatkowo ta flawinę została sklasyfikowana jako zapewniająca jadowi węża jego kwintesencję ciemnożółtego zabarwienia, co pokazano na rycinie 2.
Jedna niezwykła cecha zgłoszona dla sv-LAAO dotyczy właściwości białka inaktywacji na zimno i reaktywacji na ciepło. W związku z tym większość sv-LAAO uważa się za enzymy termolabilne .
Enzym ten należy do rodziny oksydoreduktaz , szczególnie tych działających na grupę donorów CH-NH2 z tlenem jako akceptorem. Systematyczna nazwa tej klasy enzymów to L-aminokwas: oksydoreduktaza tlenowa (deaminująca) . Enzym ten jest również nazywany oksydazą ophio-aminokwasową . Pod koniec 2007 roku rozwiązano 11 struktur dla tej klasy enzymów o kodach dostępu PDB 1F8R , 1F8S , 1REO , 1TDK , 1TDN , 1TDO , 2IID , 2JAE , 2JB1 , 2JB2 i 2JB3 .
Funkcja biologiczna
Specyficzność
Zbadano specyficzne działania sv-LAAO z różnymi L-aminokwasami. Wiele badań pokazuje, że wiele sv-LAAO wykazuje preferencję dla hydrofobowych L-aminokwasów jako substratów. Na przykład wyniki wskazują, że większość sv-LAAO wykazuje stosunkowo wysoką specyficzność wobec aminokwasów hydrofobowych , takich jak L- Met , L- Leu i L- Ile oprócz aminokwasów aromatycznych , takich jak L- Phe i L- Trp .
Działalność
Enzym ten bierze udział w 8 szlakach metabolicznych : metabolizm alaniny i asparaginianu , metabolizm metioniny , rozkład waliny , leucyny i izoleucyny , metabolizm tyrozyny , metabolizm fenyloalaniny , metabolizm tryptofanu , fenyloalanina , biosynteza tyrozyny i tryptofanu oraz biosynteza alkaloidów . Zatrudnia jednego kofaktora , dinukleotyd flawinoadeninowy (FAD). Enzym wiąże się z FAD w pierwszym etapie procesu katalitycznego, redukując w ten sposób FAD do FADH 2 . FAD jest regenerowany z FADH 2 przez utlenianie w wyniku redukcji O 2 do H 2 O 2 . Mechanizm przebiega poprzez oksydacyjną deaminację L-aminokwasu, która daje pośredni iminokwas . Po hydrolizie związku pośredniego enzym z powodzeniem daje 2-oksokwas, jak pokazano na Schemacie 1.
Odkryto różnorodne aktywności biologiczne izolowanych sv-LAAO, w tym działania cytotoksyczne , przeciwbakteryjne , przeciwwirusowe i przeciwpasożytnicze , jak również efekty agregacji płytek krwi . Działania te można zdefiniować na podstawie zdolności enzymu do wywoływania stresu oksydacyjnego poprzez tworzenie rodników tlenowych i nadtlenku wodoru . Konkretny mechanizm działania sv-LAAO pod względem agregacji płytek krwi został określony mniej jasno, ponieważ wiadomo, że niektóre sv-LAAO tworzą agregaty, a niektóre są czynnikami przeciwdziałającymi agregacji.
W ostatnich badaniach wykazano, że LAAO zostały wyizolowane ze skóry i / lub wydzielin śluzowych skrzeli skalniaka, rzeźby olbrzymiej i flądry. Stwierdzono, że obecność tych enzymów jest unikalnym rodzajem białka przeciwbakteryjnego w zewnętrznej obronie stosowanej przez niektóre gatunki ryb.
Tworzenie nadtlenku wodoru
W szczególności, ze względu na jego potencjał w odpowiednich komórkach przeciwdrobnoustrojowych , przeciwnowotworowych i / lub konsumpcji aminokwasów, zainteresowanie badaniem sv-LAAO zaczęło rosnąć. Wielu autorów badało mechanizm przeciwbakteryjnego sv-LAAO. Powszechnie wiadomo, że sv-LAAO zabija i rozkłada bakterie przez H 2 O 2 , który jest wytwarzany w wyniku reakcji utleniania zachodzącej w otaczającym środowisku.
W jednym studium przypadku doniesiono, że sv-LAAO (wyizolowany z jadu C. durissus cascavella ) spowodował pęknięcie błon bakteryjnych , jednocześnie sprzyjając wynaczynieniu lub wyciekowi zawartości osocza ze struktury komórkowej. Argumentowali, że ilość wytworzonego nadtlenku wodoru była wystarczająca do zahamowania wzrostu bakterii, a zdolność enzymu do wiązania się z błonami bakteryjnymi nie jest ważna w jego działaniu przeciwbakteryjnym.
Istotność choroby
Choroby układu krążenia
Choroby układu krążenia mogą objawiać się w wielu różnych postaciach, od kardiomiopatii po chorobę tętnic obwodowych , a choroby serca pozostają kluczowym zagrożeniem dla zdrowia człowieka. Chociaż istnieją środki terapeutyczne zarówno do zapobiegania chorobom układu krążenia, jak i ich leczenia , wiele leków jest niedostępnych do użytku klinicznego ze względu na poważne skutki uboczne oraz wysoki poziom toksyczności. Jednak w ostatniej dekadzie sv-LAAO okazały się obiecujące pod względem wpływu na płytek krwi . Zaproponowano, że nadtlenek wodoru Uważa się, że odgrywa znaczącą rolę w odniesieniu do zdolności enzymów zarówno do powodowania, jak i zapobiegania tej agregacji płytek krwi . Dzięki tej wiedzy wydaje się, że sv-LAAO można ocenić jako potencjalny środek terapeutyczny w chorobach sercowo-naczyniowych ze względu na ich siłę biologiczną.
Patologia wywołana jadem
W wyniku licznych działań, w których bierze udział enzym, można wywnioskować, że prawdopodobnie istnieje pewna funkcja enzymatyczna dotycząca złożonej sieci działań toksyn jadu. Jednak rola sv-LAAO w patologii wywołanej jadem nie została wystarczająco oceniona.
Ewolucja
Ze względu na swoje właściwości przeciwbakteryjne spekulowano, że sv-LAAO są częściowo odpowiedzialne za utrzymanie i stabilizację zarówno jadu, jak i gruczołu jadowego u gatunków węży.
Dalsza lektura
- Mistrz A, Wellner D (1963). „Oksydaza aminokwasowa flawoproteiny”. W Boyer PD, Lardy H, Myrbäck K (red.). Enzymy . Tom. 7 (wyd. 2). Nowy Jork: prasa akademicka. s. 609–648.
- Wellner D, Meister A (lipiec 1960). „Krystaliczna oksydaza L-aminokwasowa z Crotalus adamanteus”. Journal of Biological Chemistry . 235 : 2013–8. PMID 13843884 .