PET do obrazowania kości
Pozytonowa tomografia emisyjna do obrazowania kości, jako technika śledzenia in vivo , umożliwia pomiar regionalnego stężenia radioaktywności proporcjonalnego do wartości pikseli obrazu uśrednionych w obszarze zainteresowania (ROI) w kościach. Pozytonowa tomografia emisyjna to funkcjonalna technika obrazowania , która wykorzystuje radioznacznik [ 18F ]NaF do wizualizacji i ilościowego określenia regionalnego metabolizmu kostnego i przepływu krwi. [ 18 F]NaF był używany do obrazowania kości przez ostatnie 60 lat. Ten artykuł koncentruje się na farmakokinetyce [ 18 F] NaF w kościach oraz różnych półilościowych i ilościowych metodach ilościowego określania regionalnego metabolizmu kości przy użyciu obrazów PET [ 18 F] NaF.
Zastosowanie [ 18 F] NaF PET
Pomiar regionalnego metabolizmu kości ma kluczowe znaczenie dla zrozumienia patofizjologii metabolicznych chorób kości.
- Biopsja kości jest uważana za złoty standard do ilościowego określania obrotu kostnego; jest jednak inwazyjny, złożony i kosztowny w wykonaniu oraz obarczony znacznymi błędami pomiarowymi.
- Pomiary biomarkerów obrotu kostnego w surowicy lub moczu są proste, tanie, szybkie i nieinwazyjne w pomiarze zmian w metabolizmie kostnym, ale dostarczają jedynie informacji o globalnym szkielecie.
- Funkcjonalna technika obrazowania polegająca na dynamicznym skanowaniu [ 18F ]NaF PET pozwala określić ilościowo regionalny obrót kostny w określonych miejscach o znaczeniu klinicznym, takich jak kręgosłup lędźwiowy i biodro , i została potwierdzona przez porównanie ze złotym standardem biopsji kości.
Farmakokinetyka [ 18F ]NaF
Chemicznie stabilny anion 18-fluorku jest radioznacznikiem wyszukującym kość w obrazowaniu szkieletu. [ 18 F] NaF ma powinowactwo do odkładania się w obszarach, w których kość jest na nowo mineralizowana. W wielu badaniach [ 18F ]NaF PET mierzono metabolizm kości w biodrze , odcinku lędźwiowym kręgosłupa i kości ramiennej . [ 18 F] NaF jest pobierany w sposób wykładniczy, reprezentujący równowagę znacznika z przestrzeniami pozakomórkowymi i płynami komórkowymi z okresem półtrwania 0,4 godziny, a nerki z okresem półtrwania 2,4 godziny. Ekstrakcja pojedynczego pasażu [ 18F ]NaF w kości wynosi 100%. Po godzinie tylko 10% wstrzykniętej aktywności pozostaje we krwi .
18 F- zajmują pozakomórkowe przestrzenie płynowe, ponieważ po pierwsze równoważą się z przestrzeniami płynowymi międzykomórkowymi , a po drugie nie są całkowicie jonami zewnątrzkomórkowymi. Fluor przechodzi w stan równowagi z fluorowodorem , który charakteryzuje się wysoką przepuszczalnością umożliwiającą przenikanie fluoru przez błonę osocza krwi . Krążenie fluoru w krwinkach czerwonych stanowi 30%. Jednak jest swobodnie dostępna dla powierzchni kości do wychwytu, ponieważ równowaga między erytrocytami a osoczem jest znacznie szybsza niż czas przejścia kapilarnego. Potwierdzają to badania wykazujące 100% jednoprzebiegową ekstrakcję 18 F- krwi pełnej przez kości i szybkie uwalnianie jonów 18 F- z erytrocytów ze stałą szybkością 0,3 na sekundę.
[ 18F ]NaF jest również wychwytywany przez niedojrzałe erytrocyty w szpiku kostnym , co odgrywa rolę w kinetyce fluorków. Wiązanie [18F]NaF z białkami osocza jest nieistotne. Na klirens nerkowy [ 18 F] NaF wpływa dieta i poziom pH , ze względu na jego ponowne wchłanianie w nefronie, w którym pośredniczy fluorowodór. Jednak w kontrolowanych eksperymentach unika się dużych różnic w szybkości przepływu moczu , utrzymując pacjentów dobrze nawodnionych.
Wymienna pula i wielkość metabolicznie aktywnych powierzchni w kościach określa ilość znacznika zgromadzonego lub wymienionego z płynem zewnątrzkomórkowym kości , chemisorpcja na kryształach hydroksyapatytu z wytworzeniem fluoroapatytu, jak pokazano w równaniu-1:
Równanie-1
Jony fluoru z krystalicznej matrycy kości są uwalniane podczas przebudowy kości, dostarczając w ten sposób miarę tempa metabolizmu kości.
Pomiar SUV-a
Definicja
Standaryzowaną wartość wychwytu (SUV) definiuje się jako stężenie w tkankach (KBq/ml) podzielone przez wstrzykniętą aktywność znormalizowaną względem masy ciała .
Stosowność
Wartość SUV mierzona na podstawie dużego obszaru ROI wygładza szum i dlatego jest bardziej odpowiednia w badaniach kości [18F]NaF, ponieważ radioznacznik jest dość równomiernie wychwytywany w całej kości. Pomiar SUV jest łatwy, tani i szybszy do wykonania, co czyni go bardziej atrakcyjnym do użytku klinicznego. Stosowano ją w diagnostyce i ocenie skuteczności terapii. SUV można zmierzyć w jednym miejscu lub w całym szkielecie za pomocą serii skanów statycznych i ograniczonych przez małe pole widzenia skanera PET.
Znane problemy
SUV okazał się użytecznym klinicznie, choć kontrowersyjnym, półilościowym narzędziem w analizie PET. Standaryzacja protokołów obrazowania i pomiar SUV w tym samym czasie po wstrzyknięciu znacznika promieniotwórczego jest konieczne, aby uzyskać prawidłowy SUV, ponieważ obrazowanie przed osiągnięciem plateau wychwytu wprowadza nieprzewidywalne błędy do 50% w przypadku SUV-ów. Szumy, rozdzielczość obrazu i rekonstrukcja wpływają na dokładność SUV-ów, ale korekcja za pomocą fantomu może zminimalizować te różnice podczas porównywania SUV-ów w wieloośrodkowych badaniach klinicznych. SUV może nie mieć czułości w pomiarze odpowiedzi na leczenie, ponieważ jest to prosta miara wychwytu znacznika w kości, na który oprócz docelowego ROI wpływa wychwyt znacznika w innych konkurencyjnych tkankach i narządach.
Pomiar Ki
Kwantyfikacja dynamicznych badań PET w celu pomiaru Ki wymaga pomiaru szkieletowych krzywych czas-aktywność (TAC) z obszaru zainteresowania (ROI) oraz funkcji wejścia tętniczego (AIF), które można zmierzyć na różne sposoby. Jednak najczęściej stosuje się korygowanie krzywych czas-aktywność krwi opartych na obrazie przy użyciu kilku próbek krwi żylnej pobranych w oddzielnych punktach czasowych podczas skanowania pacjenta. Obliczenie stałych szybkości lub K i wymaga trzech kroków:
- Pomiar funkcji wejściowej tętnicy (AIF), która działa jako pierwsza wartość wejściowa do matematycznego modelu rozkładu znacznika.
- Pomiar krzywej czas-aktywność (TAC) w interesującym regionie szkieletu, który działa jako drugie wejście do matematycznego modelu rozkładu znacznika.
- Modelowanie kinetyczne AIF i TAC przy użyciu modelowania matematycznego w celu uzyskania klirensu osoczowego netto (Ki ) dla minerału kostnego.

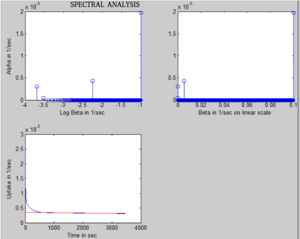
Metoda spektralna
Metoda została po raz pierwszy opisana przez Cunningham & Jones w 1993 roku do analizy danych dynamicznych PET uzyskanych w mózgu. Zakłada się, że funkcję odpowiedzi impulsowej tkanki (IRF) można opisać jako kombinację wielu wykładników. Ponieważ TAC tkanki można wyrazić jako splot zmierzonej funkcji wejściowej tętnicy z IRF, kość C (t) można wyrazić jako:
gdzie jest operatorem splotu, C ( t) to znacznika aktywności tkanki kostnej (w jednostkach: MBq / ml) w okresie czasu t, C osocze (t) to osocze stężenie znacznika (w jednostkach: MBq/ml) w czasie t, IRF(t) jest równe sumie wykładników, wartości β są ustalone między 0,0001 s-1 a 0,1 s-1 w przedziałach 0,0001 , n to liczba składowych α, które wynikają z analizy i β 1 , β 2 ,..., β n odpowiada odpowiednim składowym α 1 , α 2 ,..., α n otrzymanego widma. Wartości α są następnie szacowane na podstawie analizy poprzez dopasowanie wielowykładnicze do IRF. Punkt przecięcia dopasowania liniowego ze składową wolną tej krzywej wykładniczej uważa się za klirens osoczowy (Ki ) dla minerału kostnego.
Metoda dekonwolucji
Metoda została po raz pierwszy opisana przez Williamsa i in. w kontekście klinicznym. Metoda została wykorzystana w wielu innych badaniach. Jest to prawdopodobnie najprostsza ze wszystkich matematycznych metod obliczania K i , ale najbardziej wrażliwa na szum obecny w danych. TAC tkanki jest modelowany jako splot zmierzonej funkcji wejścia tętniczego z IRF, oszacowania IRF są uzyskiwane iteracyjnie, aby zminimalizować różnice między lewą i prawą stroną następującego równania:
gdzie jest operatorem splotu, C ( t) to znacznika aktywności tkanki kostnej (w jednostkach: MBq / ml) w okresie czasu t, C osocze (t) to osocze stężenie znacznika (w jednostkach: MBq/ml) w okresie czasu t, a IRF(t) to odpowiedź impulsowa układu (tj. w tym przypadku tkanki). Ki się z IRF w podobny sposób jak w przypadku analizy spektralnej , jak pokazano na rysunku.
modelu Hawkinsa

Pomiar Ki z dynamicznych skanów PET wymaga modelowania kinetyki znacznika w celu uzyskania parametrów modelu opisujących procesy biologiczne w kości , jak opisali Hawkins i in. Ponieważ ten model ma dwa przedziały tkankowe, jest czasem nazywany modelem z dwoma przedziałami tkankowymi. Istnieją różne wersje tego modelu; jednak rozważa się tutaj najbardziej podstawowe podejście z dwoma przedziałami tkankowymi i czterema parametrami wymiany znacznika. Cały proces modelowania kinetycznego z wykorzystaniem modelu Hawkinsa można podsumować na jednym obrazie widocznym po prawej stronie. Następujące równania różniczkowe są rozwiązywane w celu uzyskania stałych szybkości:
Stała szybkości K 1 (w jednostkach: ml/min/ml) opisuje jednokierunkowy klirens fluoru z osocza do całej tkanki kostnej, k 2 (w jednostkach: min −1 ) opisuje odwrotny transport fluoru z ECF kompartment do osocza, k 3 i k 4 (w jednostkach min -1 ) opisują transport fluoru do przodu i do tyłu z kompartmentu mineralnego kości.
Ki reprezentuje klirens netto w osoczu tylko dla minerału kostnego. Ki , jest funkcją zarówno K1 , odzwierciedlającą przepływ krwi w kości / jak i frakcji znacznika, która ulega swoistemu wiązaniu z k2 minerałem kostnym k3 ( + k3 ) . Dlatego
Hawkinsa i in. stwierdzili, że włączenie dodatkowego parametru zwanego ułamkową objętością krwi (BV), reprezentującego przestrzenie tkanki naczyniowej w ROI, poprawiło problem dopasowania danych, chociaż ta poprawa nie była statystycznie istotna.
metoda Patlaka
Metoda Patlaka opiera się na założeniu, że wsteczny przepływ znacznika z minerału kostnego do kości ECF wynosi zero (tj. k 4 = 0). Obliczenie Ki przy użyciu metody Patlaka jest prostsze niż przy użyciu regresji nieliniowej (NLR) dopasowującej funkcję wejścia tętniczego i dane krzywej czas-aktywność tkanki do modelu Hawkinsa. Należy zauważyć, że metodą Patlaka można mierzyć jedynie klirens z osocza kostnego ( K i ), a nie można mierzyć poszczególnych parametrów kinetycznych K 1 , k 2 , k 3 lub k 4 .
Stężenie znacznika w obszarze zainteresowania tkanki można przedstawić jako sumę stężenia w ECF kości i minerale kostnym. Można to matematycznie przedstawić jako
gdzie w obszarze tkanki będącym przedmiotem zainteresowania z obrazu PET, Ckość ( T) to stężenie znacznika w tkance kostnej (w jednostkach: MBq/ml) w dowolnym momencie T, C osocze (T) to stężenie w osoczu znacznika (w jednostkach: MBq / ml) w czasie T , V o to ułamek ROI zajmowany przez przedział ECF i to pole pod krzywą plazmy, to dostarczanie znacznika netto do obszaru tkanki będącej przedmiotem zainteresowania (w jednostkach: MBq.Sec/ml) w czasie T. Równanie Patlaka jest równaniem liniowym postaci
Dlatego regresja liniowa jest dopasowywana do danych wykreślonych na osiach Y i X między 4–60 minutami, aby uzyskać wartości m i c, gdzie m to nachylenie linii regresji reprezentującej Ki i c to punkt przecięcia z osią Y linia regresji reprezentująca V o .
Metoda Siddique-Blake'a
Obliczenie Ki przy użyciu funkcji wejścia tętniczego, krzywej czas-aktywność i modelu Hawkinsa było ograniczone do małego obszaru szkieletu objętego wąskim polem widzenia skanera PET podczas uzyskiwania dynamicznego skanu. Jednak Siddique i in. wykazali w 2012 r., że możliwy jest pomiar wartości K i w kościach za pomocą statycznych skanów [ 18 F]NaF PET. Blake i in. później pokazał w 2019 roku, że K i uzyskany metodą Siddique-Blake'a ma błędy dokładności mniejsze niż 10%. Podejście Siddique-Blake'a opiera się na połączeniu metody Patlaka, funkcji wejścia tętniczego opartej na półpopulacji oraz informacji, że V o nie zmienia się istotnie po leczeniu. Ta metoda wykorzystuje informację, że można wykreślić linię regresji liniowej przy użyciu danych z co najmniej dwóch punktów czasowych, aby otrzymać m i c , jak wyjaśniono w metodzie Patlaka. Jednakże, jeśli V o jest znane lub ustalone, wymagany jest tylko jeden statyczny obraz PET, aby uzyskać drugi punkt czasowy do pomiaru m , reprezentujący wartość Ki . Metodę tę należy stosować z dużą ostrożnością w innych obszarach klinicznych, w których te założenia mogą nie być prawdziwe.
SUV kontra K i
Najbardziej fundamentalna różnica między wartościami SUV i Ki polega na tym, że SUV jest prostą miarą wychwytu, który jest znormalizowany do masy ciała i wstrzykniętej aktywności. SUV nie uwzględnia dostarczania znacznika do lokalnego obszaru zainteresowania, z którego uzyskuje się pomiary, a zatem wpływa na to proces fizjologiczny zużywający [ 18 F] NaF w innym miejscu ciała. Z drugiej strony K mierzy klirens osocza do minerału kostnego, biorąc pod uwagę wychwyt znacznika w innych częściach ciała, wpływający na dostarczanie znacznika do obszaru zainteresowania, z którego uzyskuje się pomiary. Różnicę w pomiarze Ki i SUV w tkance kostnej przy użyciu [ 18F ]NaF wyjaśnili bardziej szczegółowo Blake i in.
Należy zauważyć, że większość metod obliczania Ki wymaga dynamicznego skanowania PET w ciągu godziny, z wyjątkiem metod Siddique-Blake'a. Skanowanie dynamiczne jest skomplikowane i kosztowne. Jednak obliczenie SUV wymaga pojedynczego statycznego skanu PET wykonanego około 45–60 minut po wstrzyknięciu znacznika w dowolnym obszarze zobrazowanym w szkielecie.
Wielu badaczy wykazało wysoką korelację między wartościami SUV i K i w różnych miejscach szkieletu. Jednak metody SUV i K i mogą być sprzeczne przy pomiarze odpowiedzi na leczenie. Ponieważ SUV nie został zwalidowany na podstawie histomorfometrii, jego przydatność w badaniach kości mierzących odpowiedź na leczenie i postęp choroby jest niepewna.
Zobacz też
- Kość
- Pozytonowa emisyjna tomografia komputerowa
- Krzywa czas-aktywność
- Funkcja wejścia tętniczego
- Obrazowanie medyczne
- Radiologia
- Obrazowanie molekularne
- Obrazowanie medyczne
- Scyntygrafia kości
|
Zasoby biblioteczne o PET |










