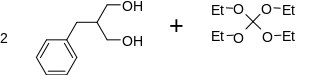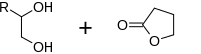Rozszerzający się monomer
Rozszerzające się monomery to monomery , które zwiększają swoją objętość (rozszerzają się) podczas polimeryzacji . Można je dodawać do preparatów monomerów , aby przeciwdziałać zwykłemu kurczeniu się objętości (podczas polimeryzacji) w celu wytworzenia produktów o wyższej jakości i trwałości. Skurcz objętościowy jest pierwszym problemem dla nietopliwych tworzyw termoutwardzalnych , ponieważ mają one ustalony kształt po zakończeniu polimeryzacji.
Tło
O jakości termoutwardzalnych ( polimerów sieciowanych ) decyduje wiele czynników, takich jak czystość użytego monomeru, czas i temperatura polimeryzacji , stechiometria komonomerów (jeśli są stosowane) czy rodzaj i ilość katalizatora lub inicjatora . Innym rzadko branym pod uwagę czynnikiem jest kurczenie się objętości (i wzrost gęstości) podczas polimeryzacji; właściwie wszystkie polimery do pewnego stopnia kurczą się podczas polimeryzacji. Ten skurcz objętościowy może prowadzić (po osiągnięciu punktu żelowania ) do naprężeń mechanicznych w polimerze (naprężenia wewnętrzne), co może powodować mikropęknięcia , pogorszenie właściwości mechanicznych lub odklejanie się od podłoża . Rozszerzalne monomery zajmują po polimeryzacji większą objętość niż wcześniej i zostały zaprojektowane tak, aby przeciwdziałać skurczowi objętościowemu po dodaniu. W przypadku innych zastosowań, takich jak precyzyjne odlewy lub wypełnienia dentystyczne , niewielkie rozszerzenie podczas polimeryzacji byłoby pożądane w celu całkowitego wypełnienia danej formy . Niemniej jednak w przypadku niektórych zastosowań nawet niewielki skurcz może być pożądany, jak w przypadku form jednoczęściowych, w celu łatwego usunięcia. Ekspandujące monomery stosuje się w celu wpływania odpowiednio na zmianę objętości podczas polimeryzacji.
Przyczyna skurczu
Skurcz obserwuje się zarówno podczas polimeryzacji, jak i sieciowania ( utwardzania ) monomerów. Ten spadek objętości jest spowodowany różnymi czynnikami. Głównym powodem jest przemieszczanie się monomerów z międzycząsteczkowej van der Waalsa do odległości kowalencyjnej , gdy podczas polimeryzacji tworzy się wiązanie kowalencyjne . Można to podkreślić na przykładzie etenu .
Można zauważyć, że odległość między monomerami zmienia się od odległości van der Waalsa (3,40 Å) do odległości kowalencyjnej pojedynczego wiązania ( 1,54 Å), co prowadzi do zmiany netto o -1,86 Å. Zmiana z dwóch wiązań podwójnych (1,34 Å) na wiązanie pojedyncze (ponownie 1,54 Å) powoduje nieznaczne rozszerzenie (+0,2 Å każde). Oba efekty zsumowane nadal powodują znaczne kurczenie się.
Niewielką rolę odgrywa ponadto zmiana entropii podczas polimeryzacji oraz gęstość upakowania, ponieważ polimer jest upakowany ściślej niż monomer. W polimeryzacji ze stopniowym wzrostem (reakcja kondensacji) eliminowane są małe cząsteczki, które po usunięciu również przyczyniają się do kurczenia. W podwyższonych temperaturach rolę odgrywa również starzenie termiczne, podczas którego nieprzereagowany monomer może polimeryzować i uwalniane są produkty degradacji oraz inne małe cząsteczki.
Konwencjonalne metody redukcji skurczu
Przeprowadzono wiele badań w celu zmniejszenia skurczu podczas polimeryzacji. Jako metody tradycyjnie stosuje się dodawanie napełniaczy, stosowanie prepolimerów , dodawanie reaktywnych rozcieńczalników i specjalnych środków sieciujących . Ogólną zasadą jest, że im mniejsza część reaktywna, tym mniejszy skurcz żywicy podczas polimeryzacji.
Wypełniacze (krzemionka, mika, kwarc itp.) zmniejszają skurcz proporcjonalnie do zastosowanej ilości, ponieważ wypełniacz o stałej objętości zastępuje kurczący się polimer. Wzrost lepkości powodowany przez wypełniacze jest niekorzystny, ponieważ ogranicza płynięcie żywicy i wypełnienia formy. Ponadto problematyczna jest ich tendencja do osiadania .
Prepolimery ulegały już w pewnym stopniu polimeryzacji. Jednak nadal są lepkie i nie są jeszcze zżelatynizowane. Ponieważ prepolimery są już częściowo spolimeryzowane, kurczenie się zmniejsza się podczas końcowego utwardzania. Im wyższa masa cząsteczkowa zastosowanych monomerów, tym mniejszy skurcz objętościowy.
Również dodatek reaktywnych rozcieńczalników może zmniejszyć skurcz proporcjonalnie do stopnia jego dodania.
Koncepcja rozszerzających się monomerów
Efekty pierścienia
| Liczba atomy węgla |
Węglowodór liniowy gęstość (g⋅cm −3 ) |
Cykliczny węglowodór gęstość (g⋅cm −3 ) |
Gęstość różnica |
|---|---|---|---|
| 4 | 0,5788 | 0,6820 | -0,1032 |
| 6 | 0,6603 | 0,7791 | -0,1188 |
| 8 | 0,7028 | 0,8337 | -0,1304 |
| 10 | 0,7310 | 0,8580 | -0,1270 |
Rozszerzające się monomery zostały opracowane na podstawie obserwacji, że skurcz podczas polimeryzacji z otwarciem pierścienia jest niższy niż w jakimkolwiek innym rodzaju polimeryzacji:
Wynika to głównie z faktu, że związki cykliczne mają większą gęstość niż ich liniowe odpowiedniki. Można to zilustrować porównaniem węglowodorów cyklicznych i liniowych (patrz tabela). Hipotetyczny proces otwarcia pierścienia cyklobutanu do n-butanu skutkowałby rozszerzeniem objętości o około 15%. Polimeryzacja związku cyklicznego powoduje zatem mniejszy skurcz objętościowy, ponieważ związki cykliczne są już stosunkowo gęste.
Można ponadto zauważyć, że im większy pierścień, tym większe rozszerzenie. Ten pierwszy efekt nazywa się efektem rozmiaru pierścienia. Jednakże, gdy cykliczne węglowodory byłyby hipotetycznie polimeryzowane (do polietylenu ), nadal występowałoby ogólne zmniejszenie objętości (ponieważ polietylen ma gęstość 0,92 g⋅cm- 3 ). Niemniej jednak kurczenie się zmniejsza się wraz ze wzrostem długości pierścienia.
Jednak dla prawdziwej polimeryzacji należy również pamiętać o naprężeniu pierścienia . Odkształcenie pierścienia zmniejsza się wraz ze wzrostem rozmiaru pierścienia i osiąga wartość bliską zeru w cykloheksanie. Można to zilustrować faktem, że oksiran łatwo polimeryzuje, podczas gdy oksolan jest zdecydowanie mniej reaktywny.
Drugim efektem jest efekt pierścienia na jednostkę objętości. Na zmianę objętości podczas polimeryzacji z otwarciem pierścienia ma również wpływ liczba polimeryzowalnych pierścieni na monomer. Można to zilustrować na przykładzie cyklopentenu, dimeru cyklopentenu, adamantanu i poli(cyklopentenu). Można zauważyć, że hipotetyczna konwersja cyklopentenu do poli(cyklopentenu) skutkowałaby skurczem objętości o 15,38%, podczas gdy konwersja dimeru cyklopentenu prowadzi do ekspansji o 5,21%, a konwersja adamantanu nawet do ekspansji o 14,15%.
Trzecim efektem jest efekt otwarcia pierścienia, który można zilustrować podczas polimeryzacji oksiranu. Podczas polimeryzacji dwie cząsteczki przemieszczają się z odległości van der Waalsa do odległości kowalencyjnej, co samo w sobie skutkowałoby skurczem o około 40% (jak to zobrazowano powyżej). W tym samym czasie pierścień otwiera się i przesuwa z odległości kowalencyjnej do bliskiej odległości van der Waalsa, co skutkowałoby rozszerzeniem o 17%. Zatem ogólna zmiana objętości to skurcz o około 23%.
To niewielkie kurczenie się podczas samej polimeryzacji z otwarciem pierścienia zależy od efektu wielkości pierścienia, liczby pierścieni na efekt objętości i efektu otwarcia pierścienia.
Rozszerzenie koncepcji monomeru
Wywodzący się z efektów pierścieniowych projekt rozszerzających się monomerów opiera się na związkach bicyklicznych . Ekspansja netto jest osiągnięta, gdy dla każdego wiązania, które ulega przesunięciu z odległości kowalencyjnej do odległości van der Waalsa, co najmniej dwa wiązania przesuwają się z odległości kowalencyjnej do bliskiej odległości van der Waalsa, jak pokazano na poniższym rysunku.
Można zauważyć, że wiązanie a) i wiązanie b) są zerwane i dlatego zmieniają się z odległości kowalencyjnej do bliskiej van der Waalsa. W tym samym czasie między dwoma monomerami powstaje wiązanie c) , co jest zmianą odległości van der waalsa na odległość kowalencyjną.
Wynika to z trzech wymagań, aby pierścienie bicyklicznego monomeru były skondensowane (pierścienie mają wspólny co najmniej jeden atom), aby każdy pierścień zawierał co najmniej jeden atom inny niż węgiel oraz aby pierścienie otwierały się w sposób asymetryczny (co oznacza na przykład, że jeden tlen tworzy grupę karbonylową, a drugi grupę eterową). Klasami związków spełniającymi te wymagania są spiroortoestry, spiroortowęglany, bicykliczne ketalelaktony i bicykliczne ortoestry.
Przegląd, synteza i polimeryzacja
Większość rozszerzających się monomerów to ortoestry , ortoestry spiro, ortoestry bicykliczne lub ortowęglany. Niektóre rozszerzające się monomery to laktony . Te klasy są wymienione w poniższej tabeli.
| Klasa monomeru | Formuła strukturalna |
|---|---|
| bicykliczny ortoester |
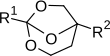
|
| cykliczny węglan |

|
| spiroortowęglan |

|
| spiroortoester |

|
| spiroortowęglan. |
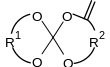
|
| nienasycony spiroortoester |

|
| bicykliczny monolakton |

|
| bicykliczny bislakton |

|
Synteza
W literaturze podaje się trzy możliwości syntezy monomerów ekspandujących na bazie ortoestrów. Pierwsza możliwość to reakcja epoksydu z laktonem :
Epoksydowy tlenek cykloheksenu i lakton γ-butyrolakton reagują z spiroortoestrem spiro-7-9-dioksacyklo[4.3.0]nonano-8,2'1'-oksacyklo-pentanem.
również reakcja epoksydu i węglanu tworząca spiroortowęglan.
Drugą możliwością jest transestryfikacja :
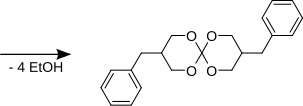
2-Benzylo-1,3-propanodiol i ortowęglan tetraetylu reagują z 3,9-bis(fenylometylo)-1,5,7,11-tetraoksaspiro[5.5]undekanem.
Możliwa jest również kondensacja analogiczna do reakcji acetalizacji .
etanodiolu i γ-butyrolakton reagują z pochodną 1,4,6-trioksa-spiro[4.4]nonanu .
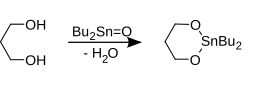
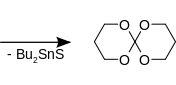
Trzecią możliwością jest użycie tlenku dibutylocyny i dwusiarczku węgla :
1,3-propanodiol reaguje z tlenkiem dibutylocyny do 2,2-dibutylo-1,3,2-dioksastannanu i dwusiarczkiem węgla do cyklicznego siarczynu 1,3-propanodiolu. Oba tworzą razem 1,5,7,11-tetraoksa-spiro[5.5]undekan
Polimeryzacja
Większość rozszerzających się monomerów jest polimeryzowana kationowo , niektóre anionowo , a bardzo nieliczne nawet rodnikowo . Ortoestry spiro tworzą po homopolimeryzacji poliestry polieterowe.
Mechanizm reakcji nie jest jeszcze szczegółowo wyjaśniony, ponieważ zachodzi kilka reakcji ubocznych. Rozszerzające się monomery można nie tylko homopolimeryzować, jak pokazano tutaj, ale także kopolimeryzować z innymi monomerami, aby przeciwdziałać ich kurczeniu.
Zwykle kwas Lewisa, taki jak eterat trifluorku boru, jest używany zarówno do syntezy ortoestru, jak i do polimeryzacji. To samo dotyczy spiroortowęglanów i bicyklicznych ortoestrów. Wszystkie trzy są, w zależności od struktury, bardzo wrażliwe na wilgoć .
Aplikacja
Rozszerzające się monomery są interesujące do zastosowania w żywicach matrycowych w radykalnie polimeryzowanych wypełnieniach dentystycznych , kompozytach o wysokiej wytrzymałości (np. w żywicach epoksydowych ), klejach, powłokach, odlewach precyzyjnych i materiałach uszczelniających przeciwdziałających kurczeniu się podczas polimeryzacji. Może to być konieczne w przypadku wypełnień dentystycznych, ponieważ skurcz polimeryzacyjny, a następnie naprężenia skurczowe w kompozycie żywicznym i na granicy wiązania mogą prowadzić do odklejania, mikroprzecieków, nadwrażliwości pozabiegowej, pogorszenia właściwości fizycznych materiału, a nawet pęknięć w zdrowym zębie Struktura. Są one używane w innych nazwanych aplikacjach w celu rozwiązania podobnych problemów.
W ostatnich czasach przedmiotem badań była indukowana promieniowaniem UV fotopolimeryzacja spiro-ortowęglanów.
- . ^ a b c d e f g hi j k Sadhir, Rajender K. (1992) Rozszerzanie monomerów: synteza, charakteryzacja i zastosowania . Prasa CRC. ISBN 0-8493-5156-1 .
- ^ Mimo że zmiana odległości od odległości van der Waalsa (3,4 Å) do pojedynczego wiązania węgiel-węgiel (1,54 Å) wynosi około 55%, została wzięta w odniesieniu do wielkości całej cząsteczki, co powoduje kurczenie się tylko 40 zamiast 55%. Wyjaśnia to również, dlaczego kurczenie się zmniejsza się wraz ze wzrostem masy cząsteczkowej
- Bibliografia _ Takata, Toshikazu; Endo, Takeshi (maj 1994). „Kationowa kopolimeryzacja cyklicznego węglanu i epoksydu poprzez pośredni spiroortowęglan”. Journal of Polymer Science Część A: Chemia polimerów . 32 (7): 1393–1397. Bibcode : 1994JPoSA..32.1393A . doi : 10.1002/pola.1994.080320722 .
- ^ Endo, Takeshi; Sato, Hiroyuki; Takata, Toshikazu (listopad 1987). „Synteza i polimeryzacja kationowa 3,9-dibenzylo-1,5,7,11-tetraoksaspiro [5,5] undekanu”. makrocząsteczki . 20 (6): 1416-1419. Bibcode : 1987MaMol..20.1416E . doi : 10.1021/ma00172a044 .
- Bibliografia _ Liu, Wenjia; Hao, Zhichao; Wu, Xiangnan; Yin, Jian; Panjiyar, Anil; Liu, Xiaoqing; Shen, Jiefei; Wang, powiesić (10 lutego 2014). „Charakterystyka kompozytu dentystycznego o niskim skurczu zawierającego rozszerzający się monomer spiroortowęglanu bismetylenu” . Międzynarodowy Dziennik Nauk Molekularnych . 15 (2): 2400–2412. doi : 10.3390/ijms15022400 . PMC 3958858 . PMID 24518683 .
- ^ ab Słońce , Xiang; Li, Yuncong; Xiong, Jie; Hu, Xiaoyi; Chen, Jihua (grudzień 2011). „Właściwości skurczowe modyfikowanych dentystycznych kompozytów żywicznych zawierających nowy spiro-ortowęglan ekspandujący monomer”. Materiały Listy . 65 (23–24): 3586–3589. doi : 10.1016/j.matlet.2011.07.097 .
- ^ a b Xu, Xiaoqiang; Zhou, Lin; Liang, Bing; Wu, Yumin; Wang, Changsong (28 maja 2014). „Synteza kopolimerów zawierających ortowęglan podwójnego spiro i stosowanych jako dodatki przeciwskurczowe w kompozycie z żywicy epoksydowej”. Technologia i inżynieria polimerów i tworzyw sztucznych . 53 (8): 753–759. doi : 10.1080/03602559.2013.869697 . S2CID 94494453 .
- ^ Hsu, Ying-Gev; Wan, Yen-Shen (15 lipca 2009). „Kationowa fotopolimeryzacja cis-2,3-tetrametyleno-1,4,6-trioksaspiro [4,4] nonanu”. Journal of Polymer Science Część A: Chemia polimerów . 47 (14): 3680–3690. Bibcode : 2009JPoSA..47.3680H . doi : 10.1002/pola.23379 .
- ^ Acosta Ortiz, Ricardo; Duarte, María Lydia Berlanga; Gomez, Amy Grace Savage; Sangermano, Marco; Garca Valdez, AÃda E (2009). „Nowe spiro-ortowęglany diolu pochodzące z glicerolu jako dodatki przeciwskurczowe do kationowej fotopolimeryzacji monomerów epoksydowych”. polimer międzynarodowy . 59 (5): 680–685. doi : 10.1002/pi.2755 .
- Bibliografia _ Giannelli S.; Ortiz, R. Acosta; Duarte, ML Berlanga; Gonzalez, AK Rueda; Valdez, AE Garcia (5 maja 2009). „Synteza hemispiroortowęglanu funkcjonalizowanego oksetanem, stosowanego jako dodatek o niskim skurczu w kationowym utwardzaniu monomerów oksetanu w ultrafiolecie”. Journal of Applied Polymer Science . 112 (3): 1780–1787. doi : 10.1002/app.29587 .
- ^ Chappelow, Cecil C.; Pinzino, Karol S.; Chen, Shin-Shi; Jeang, Li; Eick, J. David (5 stycznia 2007). „Fotopolimeryzacja nowego tetraoksaspiroundekanu i oksiranów zawierających krzem”. Journal of Applied Polymer Science . 103 (1): 336–344. doi : 10.1002/app.23961 .