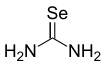
selenomocznik
|
|
|||
| Identyfikatory | |||
|---|---|---|---|
|
Model 3D ( JSmol )
|
|||
| 1734744 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.010.119 | ||
| Numer WE |
|
||
| 239756 | |||
| Siatka | C081959 | ||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
| UNII | |||
| Numer ONZ | 3283 3077 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| CH 4 N 2 se | |||
| Masa cząsteczkowa | 123,02 g/mol | ||
| Wygląd | Jednolity kolor różowy/szary | ||
| Temperatura topnienia | 200 ° C (392 ° F; 473 K) | ||
| Temperatura wrzenia | 214 ° C (417 ° F; 487 K) | ||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
  
|
|||
| Niebezpieczeństwo | |||
| H301 , H331 , H373 , H410 | |||
| P260 , P261 , P264 , P270 , P271 , P273 , P301+P310 , P304+P340 , P311 , P314 , P321 , P330 , P391 , P403+P233 , P405 , P501 | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Selenomocznik jest związkiem selenoorganicznym o wzorze SeC(NH 2 ) 2 . Jest to biała substancja stała. Ten związek zawiera rzadki przykład stabilnego, nieograniczonego podwójnego wiązania węgiel-selen. Związek jest wykorzystywany w syntezie heterocykli selenu . W porównaniu z mocznikiem , okso-analogiem selenomocznika, przeprowadzono niewiele badań tego związku ze względu na niestabilność i toksyczność związków selenu . Selenomocznik jest toksyczny w przypadku wdychania lub spożycia.
Synteza
Związek został po raz pierwszy zsyntetyzowany w 1884 roku przez Auguste'a Verneuila w reakcji selenowodoru i cyjanamidu :
- H 2 Se + NCNH 2 → Se C (NH 2 ) 2
Chociaż reakcja ta znalazła zastosowanie nawet w przemysłowej syntezie selenomocznika, bardziej nowoczesne metody dotyczą syntezy podstawionych selenomoczników. Można je zsyntetyzować przy użyciu organicznych izoselocyjanianów i amin drugorzędowych:
- RN=C=Se + NHR′R″ → Se=C(NRH)(NR′R″H)
Alternatywnie, podstawiony karbodiimid można zastosować w następujący sposób:
- RN=C=NR′ Se=C(NRH)(NR′H)
Nieruchomości
Rentgenowskie pomiary krystalograficzne kryształów w temperaturze -100 ° C dają średnie długości wiązań C=Se 1,86 Å i 1,37 Å dla C-N. Oba kąty Se-C-N i NC-C-N zmierzono przy 120°, jak oczekiwano dla zhybrydyzowanego sp 2 . Dzięki tym samym badaniom potwierdzono istnienie wiązań wodorowych Se-H w sieci krystalicznej - co sugerowano na podstawie wiązań wodorowych OH i S-H występujących w kryształach mocznika i tiomocznika .
Zarówno skrócona długość wiązania N-C, jak i dłuższe wiązanie Se=C sugerują delokalizację samotnej pary na aminach; elektrony wiążące π Se = C są przyciągane w kierunku atomu selenu, podczas gdy samotna para azotu jest przyciągana w kierunku węgla karbonylowego . Podobny efekt obserwuje się w przypadku mocznika i tiomocznika. Przechodząc od mocznika do tiomocznika do selenomocznika, podwójne wiązanie jest bardziej zdelokalizowane i dłuższe, podczas gdy wiązanie C-N σ jest silniejsze i krótsze. Pod względem struktur rezonansowych selenol postać (struktury II, III) jest bardziej rozpowszechniona w porównaniu z analogami mocznika i tiomocznika; jednak samotna para azotu selenomocznika ulega delokalizacji tylko nieznacznie bardziej niż samotna para na tiomoczniku (w przeciwieństwie do znacznie większej delokalizacji przy przechodzeniu od mocznika do tiomocznika). Te niewielkie różnice sugerują, że właściwości wynikające ze zdelokalizowanej samotnej pary azotu i destabilizacji wiązania C=S i C=Se π w tiomoczniku i selenomoczniku będą również podobne.
W przeciwieństwie do mocznika i tiomocznika, które były szeroko badane, stosunkowo niewiele badań ilościowo charakteryzuje selenomocznik. Chociaż selonu (I) jest bardziej stabilną formą, dostępne są głównie informacje jakościowe i porównawcze dotyczące tautomeryzacji selenomocznika.
W sposób porównywalny do ketonów selony również tautomeryzują:
Ponieważ większa delokalizacja elektronów samotnej pary koreluje z produktem selone, pozycja równowagi selenomocznika prawdopodobnie ma pozycję równowagi porównywalną z pozycją równowagi tiomocznika (która leży bardziej na prawo niż pozycja mocznika). Wykazano, że tiomocznik występuje głównie w postaci tionu w temperaturze 42°C w rozcieńczonym metanolu , z tautomerem tionolu prawie nie występującym w obojętnym pH .
Reaktywność
Ważną klasą reakcji selenomocznika jest tworzenie heterocykli . Niektóre związki heterocykliczne zawierające selen wykazują między innymi działanie przeciwzapalne i przeciwnowotworowe . Stosowanie selenomocznika jako prekursora jest uważane za najskuteczniejszy sposób syntezy związków heterocyklicznych zawierających selen.
Inną klasą reakcji jest kompleksowanie selenomocznika z metalami przejściowymi i metaloidami . Jego zdolność do działania jako skuteczny ligand przypisuje się efektowi elektronodonorowemu grup aminowych i wynikającej z tego stabilizacji wiązania selen-metal π . W kompleksach selenomocznika zaobserwowano jedynie wiązanie selen-metal, w przeciwieństwie do mocznikowych i tiomocznikowych odpowiedników, które również wiążą się poprzez atom azotu.