oksym acetonu
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
N -hydroksypropano-2-imina |
|
| Inne nazwy acetoksym; N -hydroksy-2-propanimina; ketoksym metylowo-metylowy; Oksym 2-propanonu
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.004.383 |
| Numer WE |
|
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C3H7NO _ _ _ _ _ | |
| Masa cząsteczkowa | 73,095 g · mol -1 |
| Wygląd | Biała igła jak kryształy |
| Gęstość | 0,901 g/ml |
| Temperatura topnienia | 60 do 63 ° C (140 do 145 ° F; 333 do 336 K) |
| Temperatura wrzenia | 135 ° C (275 ° F; 408 K) |
| 330 g/L (20°C) | |
| -44,42 ·10-6 cm3 / mol | |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Może być szkodliwy w przypadku połknięcia |
| Oznakowanie GHS : | |
   
|
|
| Niebezpieczeństwo | |
| H228 , H302 , H317 , H318 , H351 | |
| P201 , P202 , P210 , P240 , P241 , P261 , P264 , P270 , P272 , P280 , P281 , P301+P312 , P302 +P352 , P305+P351+P338 , P308+P313 , P310 , P 321 , P330 , P333 + P313 , P363 , P370+P378 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | 60 ° C (140 ° F; 333 K) |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
4000 mg/kg Dootrzewnowo mysz |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
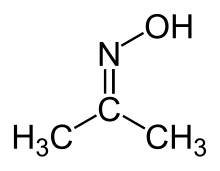
Oksym acetonu ( acetoksym ) jest związkiem organicznym o wzorze (CH 3 ) 2 CNOH. Jest to najprostszy przykład ketoksymu . Jest to biała krystaliczna substancja stała rozpuszczalna w wodzie, etanolu, eterze, chloroformie i ligroinie. Jest stosowany jako odczynnik w syntezie organicznej .
Oksym acetonu (acetoksym) został po raz pierwszy przygotowany i nazwany w 1882 roku przez niemieckiego chemika Victora Meyera i jego szwajcarskiego ucznia Aloisa Janny'ego.
Przygotowanie
Oksym acetonu jest syntetyzowany przez kondensację acetonu i hydroksyloaminy w obecności HCl:
- (CH 3 ) 2 CO + H 2 NOH → (CH 3 ) 2 CNOH + H 2 O
Można go również wytworzyć przez utlenianie acetonu w obecności nadtlenku wodoru.
Używa
Oksym acetonu jest doskonałym inhibitorem korozji (odtleniaczem) o niższej toksyczności i większej stabilności w porównaniu do powszechnie stosowanej hydrazyny . Jest również przydatny w oznaczaniu ketonów, kobaltu oraz w syntezie organicznej.
