Żelazochrom
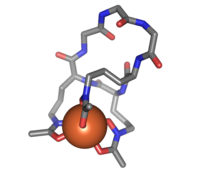 Żelazochrom (sztyfty) związany z atomem żelaza (pomarańczowy)
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
N- [3-[4,16-bis[3-[acetylo(oksydo)amino]propylo]-2,5,8,11,14,17-heksaokso-3,6,9,12,15,18- heksazacyklooktadec-1-ylo]propylo] -N -oksydoacetamid; żelazo(3+)
|
|
| Identyfikatory | |
|
|
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.036.081 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C27H42FeN9O12 _ _ _ _ _ _ _ _ | |
| Masa cząsteczkowa | 740,529 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Ferrichrom to cykliczny heksapeptyd , który tworzy kompleks z atomami żelaza. Jest sideroforem złożonym z trzech reszt glicyny i trzech zmodyfikowanych ornityny z grupami hydroksamianowymi [-N(OH)C(=O)C-]. 6 atomów tlenu z trzech grup hydroksamianowych wiąże Fe(III) w niemal idealnej koordynacji oktaedrycznej.
Ferrichrom został po raz pierwszy wyizolowany w 1952 roku i stwierdzono, że jest wytwarzany przez grzyby z rodzaju Aspergillus , Ustilago i Penicillium . Jednak w tamtym czasie nie było zrozumienia co do jego zaangażowania i wkładu w transport żelaza. Dopiero w 1957 roku, dzięki Joe Neilandsa , po raz pierwszy zauważył, że Ferrichrome był w stanie działać jako środek transportu żelaza.
Funkcja biologiczna
Ferrichrome to siderofory, które są czynnikami chelatującymi metale o niskiej masie cząsteczkowej i są wytwarzane przez mikroorganizmy i rośliny rosnące w warunkach o niskiej zawartości żelaza. Główną funkcją sideroforów jest chelatowanie żelaza (Fe 3+ ) z nierozpuszczalnych minerałów ze środowiska i udostępnianie go komórkom drobnoustrojów i roślin. Żelazo jest ważne w funkcjach biologicznych, ponieważ działa jako katalizator w procesach enzymatycznych, a także w przenoszeniu elektronów, syntezie DNA i RNA oraz metabolizmie tlenu. Chociaż żelazo jest czwartym najbardziej rozpowszechnionym pierwiastkiem w skorupie ziemskiej, biodostępność żelaza w środowisku tlenowym jest niska ze względu na tworzenie się nierozpuszczalnych wodorotlenków żelaza. Przy ograniczeniu żelaza bakterie wychwytują żelazo żelazowe (Fe 3+ ) poprzez regulację w górę wydzielania sideroforów w celu zaspokojenia ich wymagań żywieniowych. Niedawne badania wykazały, że ferrichrom był stosowany jako cząsteczka hamująca nowotwór, wytwarzana przez L. casei . Badanie przeprowadzone przez Wydział Medycyny i Uniwersytet Medyczny Asahikawa sugeruje, że ferrichrom ma większe działanie hamujące nowotwór niż inne leki stosowane obecnie w walce z rakiem okrężnicy, w tym cisplatyna i 5-fluorouracyl . Ferrichrome miał również mniejszy wpływ na nienowotworowe komórki jelitowe niż dwa wcześniej wspomniane leki przeciwnowotworowe. Stwierdzono, że ferrichrom aktywuje N-końcowe kinazy C-Jun , które indukują apoptozę . Indukcja apoptozy przez ferrichrom jest zmniejszana przez hamowanie szlaku sygnałowego kinazy N-końcowej c-jun.
Wychwyt
Żelazo jest niezbędne do najważniejszych procesów biologicznych, takich jak synteza DNA i RNA, glikoliza, wytwarzanie energii, wiązanie azotu i fotosynteza, dlatego pobieranie żelaza ze środowiska i transport do organizmu są krytycznymi procesami życiowymi dla prawie wszystkich organizmów. Problem polega na tym, że gdy żelazo ze środowiska jest wystawione na działanie tlenu, zostaje zmineralizowane do nierozpuszczalnej formy oksywodorotlenku żelazowego, który nie może być transportowany do komórek, a zatem nie jest dostępny do wykorzystania przez komórkę. Aby temu zaradzić, bakterie, grzyby i niektóre rośliny syntetyzują siderofory i wydzielają je do środowiska pozakomórkowego, w którym może zachodzić wiązanie żelaza. Należy zauważyć, że drobnoustroje wytwarzają własny rodzaj sideroforów, dzięki czemu nie konkurują z innymi organizmami o pobieranie żelaza. Na przykład saccharomyces cerevisiae to gatunek drożdży, który może pobierać siderofor związany z żelazem przez transportery z rodziny ARN. [Fe 3+ (siderofor)] (n-3)- wiąże się z receptorem-transporterem na powierzchni komórki, a następnie jest wychwytywany. Dokładny mechanizm, w jaki żelazo dostaje się do komórki za pomocą tych transporterów, nie jest poznany, ale wiadomo, że po wejściu do komórki gromadzi się w cytosolu. W saccharomyces cerevisiae ferrichrom jest specyficznie wychwytywany przez ARN1P, ponieważ ma 2 miejsca wiązania, a ferrichrom może być miejscem o wyższym powinowactwie poprzez endocytozę. Chelaty ferrichromu pozostają stabilne w komórce i umożliwiają magazynowanie żelaza, ale można je łatwo zmobilizować, aby zaspokoić potrzeby metaboliczne komórki.
Usuwanie Fe 3+ następuje poprzez redukcję Fe 3+ do Fe 2+ . Strategia redukcji pomaga uczynić żelazo bardziej rozpuszczalnym w wodzie i pozwala żelazu stać się bardziej biodostępnym , aby mogło nastąpić wychwyt. Dzieje się tak dlatego, że produkt Fe 2+ nie jest w stanie mineralizować jak Fe 3+ , ponieważ nie wiąże się znacząco z ligandem chelatowym , który jest przeznaczony do wiązania Fe 3+ . Oprócz tego, produkt Fe 3+ może również uwalniać Fe 2+ z ligandów chelatowych, które zostały zaprojektowane do wiązania Fe 3+ . Fe 2+ ma niewielkie lub żadne powinowactwo do ligandu sideroforowego i to usunięcie jest konieczne do stosowania i przechowywania. Dzieje się tak, ponieważ Fe 2+ jest kwasem pośrednim, dlatego nie jest w stanie znacząco wiązać się z ligandami chelatowymi sideroforu i może wiązać się tylko ze znacznie niższym powinowactwem. Natomiast Fe 3+ jest twardą zasadą i może wiązać się z ligandami chelatowymi sideroforu ze znacznie wyższym powinowactwem. Kompleksy sideroforów Fe 3+ są wychwytywane do błony bakteryjnej przez aktywne mechanizmy transportowe. Ten proces wychwytu jest w stanie rozpoznać różne cechy strukturalne sideroforów i przetransportować kompleksy Fe 3+ do peryplazmy .
Wiązanie sideroforowe
Główne typy sideroforów mają koordynujące ligandy katecholowe, hydroksamianowe i karboksylanowe. Przykład sideroforu katecholowego obejmuje enterobaktynę . Przykłady sideroforów hydroksamianowych obejmują desferoksaminę , ferrychrom, aerobaktynę , kwas rodotorulowy i alkaliginę. Aerobaktyna jest również sideroforem karboksylanowym. Triskatecholanowy siderofor, enterobaktyna, ma wyższe powinowactwo wiązania logβ 110 = 49 z żelazem żelazowym w porównaniu z żelazochromem, który ma powinowactwo wiązania logβ 110 = 29,07. Dlatego konkurowałby z innym sideroforem i wiązałby więcej dostępnego w środowisku Fe 3+ . Nie wiąże innych metali w dużym stężeniu ze względu na wysoką specyficzność Fe 3+ . Siderofor trishydroksamianowy, desferoksamina, ma powinowactwo wiązania logβ 110 = 30,6 i ma mniejsze powinowactwo wiązania w porównaniu z ferrichromem. Dlatego siderofor desferrioksaminy może również konkurować z Ferrichromem i wiązać więcej dostępnego w środowisku Fe3 + . Jednak siderofory bishydroksamianowe aerobaktyna (logβ 110 = 22,5), kwas rodotorulowy (logβ 110 = 21,55) i alcaligin (logβ 110 = 23,5) nie będą w stanie konkurować z sideroforami triskatecholowymi i trishydroksamianowymi, ponieważ nie mają one wysokiej zawartości Fe specyficzność 3+ . Dlatego nie są w stanie związać większej ilości dostępnego ze środowiska Fe 3+ .
Żelazo w stanie trójwartościowym ma konfigurację elektronową d5 , dlatego jego kompleksy są preferencyjnie sześciokoordynacyjne, quasi-oktaedryczne. Pod względem zasady HSAB siderofory żelazowe mają atomy donorowe, którymi są głównie tlen i rzadko heterocykliczny azot. Dzieje się tak dlatego, że jon żelazowy jest twardym kwasem Lewisa , a zatem żelazo żelazowe wiąże się silniej z twardym anionowym donorem tlenu.
Mechanizm wychwytu FhuA
E. coli ma białko receptorowe zwane FhuA (hydroksyaminian żelazowy).
FhuA jest transporterem i receptorem sprzężonym z energią. Jest częścią integralnych białek błony zewnętrznej i współpracuje z białkiem przekazującym energię TonB. Bierze udział w wychwytywaniu żelaza w kompleksie z żelazochromem poprzez wiązanie i transport żelazochromu przez zewnętrzną błonę komórki.
Zielone wstążki reprezentują ścianę beczki β o długości 69 Å i średnicy 40-45 Å, która reprezentuje reszty C-końcowe. Ma 22 antyrównoległe nici β. Niebieska wstążka pośrodku to „korek”, który jest odrębną domeną dla reszt N-końcowych.
FhuA ma nić L4, a jej rolą jest transport żelazochromu do ściany β-beczki. Kompleks żelazochromu wiąże się następnie ściśle zarówno ze ścianą β-beczki, jak iz „korkiem”. W rezultacie to wiązanie wyzwala dwie kluczowe zmiany konformacyjne kompleksu żelazo-żelazochrom, aby przenieść energię do korka. Ten transfer energii powoduje kolejne zmiany konformacyjne, które transportują żelazo-żelazochrom do kieszeni peryplazmatycznej, co sygnalizuje status receptora obciążony ligandem. Te subtelne przesunięcia zakłócają wiązanie żelazo-żelazo-żelazo z korkiem, co następnie umożliwia przenikanie żelazo-żelazo-żelaza do przypuszczalnego obszaru tworzącego kanały. Wewnętrzna ściana beczki β zapewnia szereg słabych miejsc wiązania, które przyciągają żelazochrom. FhuD jest białkiem wiążącym o wysokim powinowactwie w kieszeni peryplazmatycznej, które również pomaga w jednokierunkowym transporcie przez otoczkę komórki.
Zobacz też
- ^ Ferrichrome zarchiwizowane 13.01.2010 w Wayback Machine , Wirtualne Muzeum Minerałów i Molekuł, University of Wisconsin
- ^ a b Kenneth Raymond - The Human / Bacterial Arms Race for Iron , pobrane 2021-12-04
- ^ Ahmed E, Holmström SJ (maj 2014). „Siderofory w badaniach środowiskowych: role i zastosowania” . Biotechnologia mikrobiologiczna . 7 (3): 196–208. doi : 10.1111/1751-7915.12117 . PMC 3992016 . PMID 24576157 .
- ^ Loper JE, Kupujący JS (wrzesień 1990). „Siderofory w interakcjach drobnoustrojów na powierzchniach roślin”. Molekularne interakcje roślina-drobnoustroj . 4 : 5–13. doi : 10.1094/mpmi-4-005 .
- ^ Chatterjee A, O'Brian MR (kwiecień 2018). „Szybka ewolucja bakteryjnego systemu pozyskiwania żelaza” . Mikrobiologia Molekularna . 108 (1): 90–100. doi : 10.1111/mm.13918 . PMC 5867251 . PMID 29381237 .
- ^ Konishi H, Fujiya M, Tanaka H, Ueno N, Moriichi K, Sasajima J, et al. (sierpień 2016). „Żelazchrom pochodzący z probiotyków hamuje progresję raka okrężnicy poprzez apoptozę za pośrednictwem JNK” . Komunikacja natury . 7 : 12365. doi : 10.1038/ncomms12365 . PMC 4987524 . PMID 27507542 .
- ^ a b c d Hannauer M, Barda Y, Mislin GL, Shanzer A, Schalk IJ (marzec 2010). „Szlak wychwytu żelazochromu u Pseudomonas aeruginosa obejmuje mechanizm uwalniania żelaza z acylacją sideroforu i recyklingiem zmodyfikowanego desferrichromu” . Journal of Bacteriology . 192 (5): 1212–1220. doi : 10.1128/JB.01539-09 . PMC 2820845 . PMID 20047910 .
- ^ a b c d e f Moore RE, Kim Y, Philpott CC (maj 2003). „Mechanizm transportu ferrichromu przez Arn1p i jego metabolizm w Saccharomyces cerevisiae” . Proceedings of the National Academy of Sciences of the United States of America . 100 (10): 5664–5669. Bibcode : 2003PNAS..100.5664M . doi : 10.1073/pnas.1030323100 . PMC 156258 . PMID 12721368 .
- ^ Inomata T, Eguchi H, Funahashi Y, Ozawa T, Masuda H (styczeń 2012). „Zachowanie adsorpcyjne drobnoustrojów na chipie QCM zmodyfikowanym sztucznym kompleksem siderofor-Fe3 +”. Langmuira . 28 (2): 1611–1617. doi : 10.1021/la203250n . PMID 22182317 .
- ^ Drechsel H Jung G (1998). „Syderofory peptydowe” . Journal of Peptide Science . 4 (3): 147–181. doi : 10.1002/(SICI)1099-1387(199805)4:3<147::AID-PSC136>3.0.CO;2-C . ISSN 1099-1387 . PMID 9643626 . S2CID 31107931 .
- ^ a b Braun V (czerwiec 2009). „FhuA (TonA), kariera białka” . Journal of Bacteriology . 191 (11): 3431–3436. doi : 10.1128/JB.00106-09 . PMC 2681897 . PMID 19329642 .
- ^ a b c d e f g Ferguson AD, Hofmann E, Coulton JW, Diederichs K, Welte W (grudzień 1998). „Transport żelaza za pośrednictwem sideroforów: struktura krystaliczna FhuA ze związanym lipopolisacharydem” . nauka . 282 (5397): 2215–2220. Bibcode : 1998Sci...282.2215F . doi : 10.1126/science.282.5397.2215 . PMID 9856937 .

