Mikroskopia
Mikroskopia to dziedzina techniki wykorzystująca mikroskopy do oglądania obiektów i obszarów obiektów, których nie można zobaczyć gołym okiem (obiektów, które nie mieszczą się w zakresie rozdzielczości normalnego oka). Istnieją trzy dobrze znane gałęzie mikroskopii: optyczna , elektronowa i skaningowa , wraz z rozwijającą się dziedziną mikroskopii rentgenowskiej . [ potrzebne źródło ]
Mikroskopia optyczna i mikroskopia elektronowa obejmują dyfrakcję , odbicie lub załamanie promieniowania elektromagnetycznego /wiązek elektronów oddziałujących z preparatem oraz zbieranie rozproszonego promieniowania lub innego sygnału w celu stworzenia obrazu. Proces ten można przeprowadzić przez napromieniowanie próbki szerokim polem (na przykład standardowa mikroskopia świetlna i transmisyjna mikroskopia elektronowa ) lub skanowanie cienkiej wiązki nad próbką (na przykład konfokalna laserowa mikroskopia skaningowa i skaningowa mikroskopia elektronowa ). Mikroskopia sondy skanującej polega na interakcji sondy skanującej z powierzchnią badanego obiektu. Rozwój mikroskopii zrewolucjonizował biologię , dał początek dziedzinie histologii i dlatego pozostaje podstawową techniką w naukach przyrodniczych i fizycznych . Mikroskopia rentgenowska jest trójwymiarowa i nieniszcząca, co pozwala na wielokrotne obrazowanie tej samej próbki na miejscu lub badania 4D i zapewnienie możliwości „zajrzenia do środka” badanej próbki przed poświęceniem jej technikom o wyższej rozdzielczości. Mikroskop rentgenowski 3D wykorzystuje technikę tomografii komputerowej ( microCT ), obracając próbkę o 360 stopni i rekonstruując obrazy. CT jest zwykle przeprowadzane za pomocą płaskiego wyświetlacza. Mikroskop rentgenowski 3D wykorzystuje szereg obiektywów, np. od 4X do 40X, i może również zawierać płaski panel.
Historia

Dziedzina mikroskopii ( mikroskopii optycznej ) sięga co najmniej XVII wieku. Wcześniejsze mikroskopy, jednosoczewkowe szkła powiększające o ograniczonym powiększeniu, datowane są co najmniej tak daleko, jak szerokie zastosowanie soczewek w okularach w XIII wieku, ale bardziej zaawansowane mikroskopy złożone pojawiły się po raz pierwszy w Europie około 1620 roku. Najwcześniejsi praktycy mikroskopii to Galileo Galilei , który odkrył w 1610 roku, że może z bliska skupić swój teleskop, aby zobaczyć małe obiekty z bliska i Cornelis Drebbel , który mógł wynaleźć mikroskop złożony około 1620 r. Antonie van Leeuwenhoek opracował prosty mikroskop o bardzo dużym powiększeniu w latach 70. XVII wieku i jest często uważany za pierwszego uznanego mikroskopistę i mikrobiologa .
Mikroskopia optyczna
Mikroskopia optyczna lub świetlna obejmuje przepuszczanie światła widzialnego przechodzącego przez próbkę lub odbitego od próbki przez pojedynczą soczewkę lub wiele soczewek , aby umożliwić powiększony widok próbki. Powstały obraz może być wykryty bezpośrednio przez oko, zobrazowany na kliszy fotograficznej lub przechwycony cyfrowo . Podstawowy mikroskop świetlny składa się z pojedynczej soczewki wraz z nasadkami, czyli systemu soczewek i aparatury obrazującej wraz z odpowiednim sprzętem oświetleniowym, stolikiem próbnym i wspornikiem. Najnowszym osiągnięciem jest mikroskop cyfrowy , który wykorzystuje a Kamera CCD do ustawiania ostrości na interesującym eksponacie. Obraz wyświetlany jest na ekranie komputera, więc okulary są zbędne. [ potrzebne źródło ]
Ograniczenia
Ograniczenia standardowej mikroskopii optycznej ( mikroskopii jasnego pola ) leżą w trzech obszarach;
- Ta technika może skutecznie obrazować tylko ciemne lub silnie załamujące światło obiekty.
- Istnieje rozdzielczość ograniczona dyfrakcją w zależności od długości fali padającej; w zakresie widzialnym rozdzielczość mikroskopii optycznej jest ograniczona do około 0,2 mikrometra ( patrz: mikroskop ), a praktyczne powiększenie do ~1500x.
- Nieostre światło z punktów znajdujących się poza płaszczyzną ogniskowania zmniejsza wyrazistość obrazu.
W szczególności żywym komórkom na ogół brakuje wystarczającego kontrastu, aby można je było z powodzeniem badać, ponieważ wewnętrzne struktury komórki są bezbarwne i przezroczyste. Najczęstszym sposobem zwiększenia kontrastu jest barwienie struktur selektywnymi barwnikami, ale często wiąże się to z zabijaniem i utrwalaniem próbki. Barwienie może również wprowadzać artefakty , które są widocznymi szczegółami strukturalnymi, które są spowodowane obróbką próbki, a zatem nie są cechami próbki. Ogólnie techniki te wykorzystują różnice we współczynniku załamania światła struktur komórkowych. Mikroskopia w jasnym polu jest porównywalna do patrzenia przez szklane okno: nie widać szkła, a jedynie brud na szkle. Istnieje różnica, ponieważ szkło jest gęstszym materiałem, a to powoduje różnicę w fazie przechodzącego światła. Ludzkie oko nie jest wrażliwe na tę różnicę faz, ale sprytne rozwiązania optyczne zostały opracowane w celu zmiany tej różnicy fazy na różnicę amplitudy (natężenia światła). [ potrzebny cytat ]
Techniki
Aby poprawić kontrast preparatu lub podświetlić struktury w próbce, należy zastosować specjalne techniki. Dostępny jest ogromny wybór technik mikroskopowych w celu zwiększenia kontrastu lub oznaczenia próbki.
- Cztery przykłady technik transiluminacji użytych do wygenerowania kontrastu w próbce bibuły . 1,559 μm/piksel.
jasnego pola , kontrast próbki wynika z absorbancji światła w próbce
światłem spolaryzowanym krzyżowo , kontrast próbki pochodzi z rotacji światła spolaryzowanego przez próbkę
ciemnego pola , kontrast próbki pochodzi od światła rozproszonego przez próbkę
z kontrastem fazowym , kontrast próbki pochodzi z interferencji różnych długości drogi światła przez próbkę
Jasne pole
Mikroskopia jasnego pola jest najprostszą ze wszystkich technik mikroskopii świetlnej. Próbka jest oświetlana przez przechodzące światło białe, tj. oświetlana od dołu i obserwowana z góry. Ograniczenia obejmują niski kontrast większości próbek biologicznych i niską pozorną rozdzielczość ze względu na rozmycie nieostrego materiału. Prostota techniki i minimalne wymagane przygotowanie próbki to znaczące zalety. [ potrzebne źródło ]
Ukośne oświetlenie
Zastosowanie oświetlenia ukośnego (z boku) nadaje obrazowi trójwymiarowy wygląd i może uwypuklić niewidoczne w inny sposób cechy. Nowszą techniką opartą na tej metodzie jest kontrast modulacyjny Hoffmanna , system znajdujący się w odwróconych mikroskopach do użytku w hodowli komórkowej. Ukośne oświetlenie poprawia kontrast nawet w przypadku wyraźnych preparatów, jednak ponieważ światło pada poza osią, pozycja obiektu będzie się wydawać przesuwana wraz ze zmianą ostrości. To ograniczenie sprawia, że techniki takie jak cięcie optyczne lub dokładny pomiar na osi Z są niemożliwe.
Ciemne pole
Mikroskopia ciemnego pola to technika poprawiania kontrastu niewybarwionych, przezroczystych preparatów. Oświetlenie ciemnego pola wykorzystuje starannie ustawione źródło światła, aby zminimalizować ilość bezpośrednio przepuszczanego (nierozproszonego) światła wpadającego na płaszczyznę obrazu, zbierając tylko światło rozproszone przez próbkę. Ciemne pole może radykalnie poprawić kontrast obrazu – szczególnie w przypadku obiektów przezroczystych – wymagając niewielkiej konfiguracji sprzętu lub przygotowania próbki. Jednak technika ta cierpi z powodu niskiej intensywności światła w końcowym obrazie wielu próbek biologicznych i nadal ma na nią wpływ niska pozorna rozdzielczość.

Oświetlenie Rheinberga to wariant oświetlenia ciemnego pola, w którym przezroczyste, kolorowe filtry są wstawiane tuż przed kondensorem, dzięki czemu promienie światła przy dużej aperturze mają inny kolor niż te przy małej aperturze (tzn. tło próbki może być niebieskie, podczas gdy obiekt wydaje się samoświecący na czerwono). Możliwe są inne kombinacje kolorów, ale ich skuteczność jest dość zmienna.
Barwienie dyspersyjne
Barwienie dyspersyjne to technika optyczna, która daje kolorowy obraz bezbarwnego obiektu. Jest to technika barwienia optycznego i nie wymaga żadnych plam ani barwników, aby uzyskać efekt kolorystyczny. Istnieje pięć różnych konfiguracji mikroskopów stosowanych w szerszej technice barwienia dyspersyjnego. Obejmują one linię Becke'a w jasnym polu, pole ukośne, pole ciemne, kontrast fazowy i barwienie z dyspersją obiektywu.
Kontrast fazowy

Bardziej wyrafinowane techniki pokażą proporcjonalne różnice w gęstości optycznej. Kontrast fazowy jest szeroko stosowaną techniką, która pokazuje różnice we współczynniku załamania światła jako różnice w kontraście. Został opracowany przez holenderskiego fizyka Fritsa Zernike w latach 30. (za co otrzymał Nagrodę Nobla w 1953 r.). Jądro w komórce na przykład pojawi się ciemno na tle otaczającej cytoplazmy. Kontrast jest doskonały; jednak nie nadaje się do użytku z grubymi przedmiotami. Często wokół małych obiektów tworzy się aureola, która zasłania szczegóły. System składa się z okrągłego pierścienia w kondensatorze, który wytwarza stożek światła. Ten stożek jest nałożony na pierścień o podobnej wielkości w obrębie obiektywu fazowego. Każdy obiektyw ma inny rozmiar pierścienia, więc dla każdego obiektywu należy wybrać inne ustawienie kondensora. Pierścień w obiektywie ma szczególne właściwości optyczne: przede wszystkim zmniejsza intensywność światła bezpośredniego, ale co ważniejsze, tworzy sztuczną różnicę faz o około ćwierć długości fali. Ponieważ właściwości fizyczne tego światła bezpośredniego uległy zmianie, dochodzi do interferencji światła ugiętego, co skutkuje obrazem z kontrastem fazowym. Wadą mikroskopii z kontrastem fazowym jest tworzenie halo (pierścień światła halo).
Różnicowy kontrast interferencyjny
Lepsze i znacznie droższe jest zastosowanie kontrastu interferencyjnego . Różnice w gęstości optycznej pojawią się jako różnice w reliefie. Jądro w komórce faktycznie pojawi się jako globula w najczęściej używanym różnicowego kontrastu interferencyjnego według Georges'a Nomarskiego . Należy jednak pamiętać, że jest to efekt optyczny , a relief niekoniecznie oddaje rzeczywisty kształt. Kontrast jest bardzo dobry, a przysłona kondensora może być całkowicie otwarta, co zmniejsza głębię ostrości i maksymalizuje rozdzielczość.
Układ składa się ze specjalnego pryzmatu ( pryzmat Nomarskiego , pryzmat Wollastona ) w kondensorze, który rozszczepia światło na wiązkę zwykłą i nadzwyczajną. Różnica przestrzenna między dwiema wiązkami jest minimalna (mniejsza niż maksymalna rozdzielczość obiektywu). Po przejściu przez próbkę wiązki są ponownie łączone przez podobny pryzmat w obiektywie.
W jednorodnej próbce nie ma różnicy między dwiema wiązkami i nie jest generowany żaden kontrast. Jednak w pobliżu granicy załamania światła (powiedzmy jądro w cytoplazmie) różnica między wiązką zwykłą a nadzwyczajną wygeneruje relief na obrazie. Różnicowy kontrast interferencyjny wymaga do działania spolaryzowanego źródła światła ; w drodze światła należy zamontować dwa filtry polaryzacyjne, jeden pod kondensorem (polaryzator), a drugi nad obiektywem (analizator).
Uwaga: W przypadkach, gdy konstrukcja optyczna mikroskopu zapewnia znaczne boczne rozdzielenie dwóch wiązek, mamy do czynienia z klasyczną mikroskopią interferencyjną , która nie daje obrazów reliefowych, ale mimo to może być wykorzystana do ilościowego określenia masy-grubości mikroskopijnych obiektów.
Odbicie interferencyjne
Dodatkową techniką wykorzystującą interferencję jest mikroskopia interferencyjno-refleksyjna (znana również jako kontrast interferencji odbitej lub RIC). Opiera się na adhezji komórek do szkiełka, aby wytworzyć sygnał interferencyjny. Jeśli nie ma komórki przymocowanej do szkła, nie będzie zakłóceń.
Mikroskopię z odbiciem interferencyjnym można uzyskać przy użyciu tych samych elementów, które są używane w DIC, ale bez pryzmatów. Ponadto wykrywane światło jest odbijane, a nie przepuszczane, jak ma to miejsce w przypadku zastosowania technologii DIC.
Fluorescencja

Kiedy pewne związki są oświetlane światłem o wysokiej energii, emitują światło o niższej częstotliwości. Efekt ten jest znany jako fluorescencja . Często okazy wykazują charakterystyczny autofluorescencji , oparty na ich składzie chemicznym.
Metoda ta ma kluczowe znaczenie we współczesnych naukach przyrodniczych, ponieważ może być niezwykle czuła, umożliwiając wykrywanie pojedynczych cząsteczek. Wiele barwników fluorescencyjnych można stosować do barwienia struktur lub związków chemicznych. Jedną z skutecznych metod jest połączenie przeciwciał sprzężonych z fluoroforem, tak jak w przypadku barwienia immunologicznego . Przykładami powszechnie stosowanych fluoroforów są fluoresceina lub rodamina .
Przeciwciała można dostosować do związku chemicznego. Na przykład często stosowaną strategią jest sztuczna produkcja białek w oparciu o kod genetyczny (DNA). Białka te można następnie wykorzystać do immunizacji królików, tworząc przeciwciała, które wiążą się z białkiem. Przeciwciała są następnie chemicznie sprzęgane z fluoroforem i wykorzystywane do śledzenia białek w badanych komórkach.
Wysoce wydajne białka fluorescencyjne , takie jak białko zielonej fluorescencji (GFP), zostały opracowane przy użyciu techniki biologii molekularnej fuzji genów , procesu, który łączy ekspresję związku fluorescencyjnego z ekspresją białka docelowego. To złożone białko fluorescencyjne jest na ogół nietoksyczne dla organizmu i rzadko zakłóca funkcję badanego białka. Genetycznie zmodyfikowane komórki lub organizmy bezpośrednio wyrażają białka znakowane fluorescencyjnie, co umożliwia badanie funkcji oryginalnego białka na żywo .
Wzrost kryształów białka prowadzi do powstania zarówno kryształów białka, jak i soli. Oba są bezbarwne i mikroskopijne. Odzyskanie kryształów białka wymaga obrazowania, które można wykonać za pomocą wewnętrznej fluorescencji białka lub za pomocą mikroskopii transmisyjnej. Obie metody wymagają mikroskopu ultrafioletowego, ponieważ białko pochłania światło o długości fali 280 nm. Białko będzie również fluoryzować przy około 353 nm, gdy zostanie wzbudzone światłem o długości fali 280 nm.
Ponieważ emisja fluorescencji różni się długością fali (kolorem) od światła wzbudzenia, idealny obraz fluorescencyjny pokazuje tylko interesującą strukturę, która została wyznakowana barwnikiem fluorescencyjnym. Ta wysoka specyficzność doprowadziła do szerokiego zastosowania fluorescencyjnej mikroskopii świetlnej w badaniach biomedycznych. Różne barwniki fluorescencyjne mogą być używane do barwienia różnych struktur biologicznych, które następnie można wykryć jednocześnie, zachowując jednocześnie swoistość ze względu na indywidualny kolor barwnika.
Aby uniemożliwić dotarcie światła wzbudzenia do obserwatora lub detektora potrzebne są wysokiej jakości zestawy filtrów . Zwykle składają się one z filtra wzbudzenia wybierającego zakres długości fal wzbudzenia , lustra dichroicznego i filtra emisyjnego blokującego światło wzbudzenia. Większość mikroskopów fluorescencyjnych pracuje w trybie Epi-illumination (oświetlenie i detekcja z jednej strony próbki) w celu dalszego zmniejszenia ilości światła wzbudzającego wpadającego do detektora.
Zobacz też: mikroskop fluorescencyjny całkowitego wewnętrznego odbicia Neuroscience
konfokalny
Konfokalna laserowa mikroskopia skaningowa wykorzystuje skupioną wiązkę lasera (np. 488 nm), która jest skanowana w poprzek próbki w celu wzbudzenia fluorescencji punkt po punkcie. Emitowane światło jest kierowane przez otworek, aby zapobiec przedostawaniu się nieostrego światła do detektora, zwykle fotopowielacza . Obraz jest konstruowany w komputerze, wykreślając zmierzone intensywności fluorescencji zgodnie z położeniem lasera wzbudzającego. W porównaniu z pełnym oświetleniem próbki, mikroskopia konfokalna daje nieco wyższą rozdzielczość boczną i znacznie poprawia cięcie optyczne (rozdzielczość osiowa). Mikroskopia konfokalna jest zatem powszechnie stosowana tam, gdzie ważna jest struktura 3D.
Podklasą mikroskopów konfokalnych są mikroskopy z wirującymi dyskami , które są w stanie skanować wiele punktów jednocześnie w próbce. Odpowiedni dysk z otworami odrzuca nieostre światło. Detektorem światła w mikroskopie z wirującym dyskiem jest kamera cyfrowa, zazwyczaj EM-CCD lub sCMOS .
Mikroskopia dwufotonowa
Mikroskop dwufotonowy jest również laserowym mikroskopem skaningowym, ale zamiast UV, niebieskiego lub zielonego światła laserowego do wzbudzenia używany jest pulsacyjny laser podczerwony . Tylko w małym ognisku lasera intensywność jest wystarczająco wysoka, aby wygenerować fluorescencję przez wzbudzenie dwufotonowe , co oznacza, że nie jest generowana żadna fluorescencja poza ogniskiem, a do oczyszczenia obrazu nie jest potrzebny żaden otworek. Pozwala to na obrazowanie głęboko w tkance rozpraszającej, gdzie mikroskop konfokalny nie byłby w stanie skutecznie zbierać fotonów. Mikroskopy dwufotonowe z detekcją szerokiego pola są często używane do obrazowania czynnościowego, np. obrazowania wapnia , w tkance mózgowej. Są sprzedawane jako mikroskopy wielofotonowe przez kilka firm, chociaż korzyści płynące z zastosowania wzbudzenia 3-fotonowego zamiast 2-fotonowego są marginalne.
Jednopłaszczyznowa mikroskopia iluminacyjna i mikroskopia fluorescencyjna z lekkim arkuszem
Wykorzystując płaszczyznę światła utworzoną przez skupienie światła przez cylindryczną soczewkę pod wąskim kątem lub przez skanowanie linii światła w płaszczyźnie prostopadłej do osi obiektywu, można wykonać przekroje optyczne o wysokiej rozdzielczości. Oświetlenie pojedynczej płaszczyzny lub oświetlenie arkusza światła jest również realizowane przy użyciu technik kształtowania wiązki obejmujących ekspandery wiązki z wieloma pryzmatami . Obrazy są rejestrowane przez matryce CCD. Warianty te umożliwiają bardzo szybkie przechwytywanie obrazu o wysokim stosunku sygnału do szumu.
Mikroskopia wielofotonowa o szerokim polu widzenia
Wielofotonowa mikroskopia szerokokątna odnosi się do optycznej techniki obrazowania nieliniowego, w której duży obszar obiektu jest oświetlany i obrazowany bez potrzeby skanowania. Do wywołania nieliniowych procesów optycznych, takich jak fluorescencja dwufotonowa lub generowanie drugiej harmonicznej , wymagane są wysokie natężenia . W skaningowych mikroskopach wielofotonowych wysokie intensywności uzyskuje się przez ścisłe skupienie światła, a obraz uzyskuje się przez skanowanie wiązką. W szerokokątnej mikroskopii wielofotonowej wysokie intensywności najlepiej osiąga się przy użyciu ze wzmacniaczem optycznym , aby uzyskać duże pole widzenia (~100 µm). Obraz w tym przypadku uzyskiwany jest jako pojedyncza klatka z kamery CCD bez konieczności skanowania, co czyni tę technikę szczególnie przydatną do jednoczesnej wizualizacji procesów dynamicznych w całym obiekcie zainteresowania. Dzięki wielofotonowej mikroskopii szerokokątnej częstotliwość wyświetlania klatek można zwiększyć nawet 1000-krotnie w porównaniu z wielofotonową mikroskopią skaningową . Jednak w tkance rozpraszającej jakość obrazu gwałtownie spada wraz ze wzrostem głębokości.
Dekonwolucja
Mikroskopia fluorescencyjna to potężna technika umożliwiająca pokazanie specjalnie oznakowanych struktur w złożonym środowisku i dostarczenie trójwymiarowych informacji o strukturach biologicznych. Jednak informacja ta jest zamazana przez fakt, że po oświetleniu wszystkie struktury oznakowane fluorescencyjnie emitują światło, niezależnie od tego, czy są ostre, czy nie. Tak więc obraz określonej struktury jest zawsze zamazany przez światło z nieostrych struktur. Zjawisko to powoduje utratę kontrastu, zwłaszcza w przypadku stosowania obiektywów o wysokiej rozdzielczości, zazwyczaj obiektywów olejowych o wysokiej aperturze numerycznej.
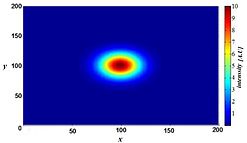
Jednak rozmycie nie jest spowodowane przypadkowymi procesami, takimi jak rozpraszanie światła, ale może być dobrze zdefiniowane przez właściwości optyczne tworzenia obrazu w mikroskopowym systemie obrazowania. Jeśli weźmiemy pod uwagę małe fluorescencyjne źródło światła (zasadniczo jasny punkt), światło pochodzące z tego punktu rozprzestrzenia się dalej z naszej perspektywy, gdy punkt staje się coraz bardziej nieostry. W idealnych warunkach daje to kształt „klepsydry” tego źródła punktowego w trzecim (osiowym) wymiarze. Ten kształt nazywa się funkcją rozrzutu punktów (PSF) systemu obrazowania mikroskopu. Ponieważ każdy obraz fluorescencyjny składa się z dużej liczby takich małych fluorescencyjnych źródeł światła, mówi się, że obraz jest „spleciony przez funkcję rozproszenia punktów”. Matematycznie modelowany PSF terahercowego systemu obrazowania impulsowego lasera pokazano po prawej stronie.
Wyjście systemu obrazowania można opisać za pomocą równania:
Gdzie n jest szumem addytywnym. Znajomość tej funkcji rozproszenia punktowego oznacza, że możliwe jest do pewnego stopnia odwrócenie tego procesu metodami komputerowymi, powszechnie znanymi jako mikroskopia dekonwolucyjna . Dostępne są różne algorytmy dekonwolucji 2D lub 3D. Można je z grubsza podzielić na nieregenerujące i regenerujące metody. Podczas gdy metody nieodtwarzające mogą poprawić kontrast poprzez usunięcie nieostrego światła z płaszczyzn ogniskowych, tylko metody odtwórcze mogą faktycznie ponownie przypisać światło do właściwego miejsca pochodzenia. Przetwarzanie obrazów fluorescencyjnych w ten sposób może być zaletą w porównaniu z bezpośrednim pozyskiwaniem obrazów bez nieostrego światła, takich jak obrazy z mikroskopii konfokalnej , ponieważ eliminowane w inny sposób sygnały świetlne stają się użytecznymi informacjami. W przypadku dekonwolucji 3D zwykle zapewnia się serię obrazów wykonanych z różnych płaszczyzn ogniskowych (zwanych stosem Z) oraz wiedzę o PSF, którą można wyprowadzić eksperymentalnie lub teoretycznie ze znajomości wszystkich parametrów mikroskopu.
Techniki subdyfrakcyjne

W ostatnim czasie opracowano wiele technik mikroskopii superrozdzielczej, które pozwalają obejść granicę dyfrakcji .
Osiąga się to głównie poprzez wielokrotne obrazowanie wystarczająco statycznej próbki i modyfikację światła wzbudzającego lub obserwację zmian stochastycznych w obrazie. Stosowane są metody dekonwolucji opisane w poprzedniej sekcji, które usuwają rozmycie wywołane PSF i przypisują matematycznie „poprawne” pochodzenie światła, aczkolwiek z nieco innym zrozumieniem, co oznacza wartość piksela. Zakładając że przez większość czasu pojedynczy fluorofor tworzy jedną plamkę na pojedynczym zdjęciu, plamki na obrazach można zastąpić ich obliczoną pozycją, znacznie poprawiając rozdzielczość znacznie poniżej granicy dyfrakcji.
Aby zrealizować to założenie, wiedza i chemiczna kontrola nad fotofizyką fluoroforów jest podstawą tych technik, dzięki którym uzyskuje się rozdzielczość ~ 20 nanometrów.
Szeregowa mikroskopia amplifikowana z kodowaniem czasowym
fotodetektor jednopikselowy w celu wyeliminowania potrzeby stosowania matryca detektorów i ograniczenia czasu odczytu Metoda jest co najmniej 1000 razy szybsza niż najnowocześniejsze kamery CCD i CMOS . W związku z tym jest potencjalnie przydatny w zastosowaniach naukowych, przemysłowych i biomedycznych, które wymagają dużych szybkości akwizycji obrazu, w tym diagnostyki w czasie rzeczywistym i oceny fal uderzeniowych, mikrofluidyka , MEMS i chirurgia laserowa .
Rozszerzenia
Większość nowoczesnych instrumentów zapewnia proste rozwiązania do mikrofotografii i elektronicznego zapisu obrazu. Jednak takie możliwości nie zawsze są obecne, a bardziej doświadczony mikroskopista może preferować ręcznie rysowany obraz od fotografii. Dzieje się tak, ponieważ mikroskopista ze znajomością tematu może dokładnie przekształcić trójwymiarowy obraz w precyzyjny dwuwymiarowy rysunek. Jednak w fotografii lub innym systemie przechwytywania obrazu tylko jedna cienka płaszczyzna jest zawsze dobrze ostra. [ potrzebne źródło ]
Tworzenie dokładnych mikrofotografii wymaga techniki mikroskopowej z użyciem okularu jednookularowego. Istotne jest, aby oboje oczu było otwartych, a oko, które nie patrzy przez mikroskop, było skoncentrowane na kartce papieru na ławce obok mikroskopu. Przy odrobinie praktyki i bez poruszania głową lub oczami można dokładnie prześledzić obserwowane kształty, jednocześnie „widząc” punkt ołówka na obrazie mikroskopowym. [ potrzebne źródło ]
Zawsze mniej męcząca jest obserwacja z wyostrzonym mikroskopem, dzięki czemu obraz widziany jest w nieskończoności i przez cały czas przy otwartych obojgu oczach. [ potrzebne źródło ]
Inne ulepszenia
Mikrospektroskopia: spektroskopia z mikroskopem
rentgenowskie
Ponieważ rozdzielczość zależy od długości fali światła. Mikroskopia elektronowa jest rozwijana od lat trzydziestych XX wieku i wykorzystuje wiązki elektronów zamiast światła. Ze względu na znacznie mniejszą długość fali wiązki elektronów rozdzielczość jest znacznie wyższa.
Mikroskopia rentgenowska, choć mniej powszechna, została również opracowana od późnych lat czterdziestych XX wieku. Rozdzielczość mikroskopii rentgenowskiej leży pomiędzy mikroskopią świetlną a mikroskopią elektronową.
Mikroskopia elektronowa
Aż do wynalezienia mikroskopii subdyfrakcyjnej długość fali światła ograniczała rozdzielczość tradycyjnej mikroskopii do około 0,2 mikrometra. Aby uzyskać wyższą rozdzielczość, w mikroskopach elektronowych stosuje się wiązkę elektronów o znacznie mniejszej długości fali.
- Transmisyjna mikroskopia elektronowa (TEM) jest dość podobna do złożonego mikroskopu świetlnego, wysyłając wiązkę elektronów przez bardzo cienki wycinek próbki. Granica rozdzielczości w 2005 roku wynosiła około 0,05 [ wątpliwe ] nanometra i od tego czasu nie wzrosła znacząco.
- Skaningowa mikroskopia elektronowa (SEM) wizualizuje szczegóły na powierzchni próbek i daje bardzo ładny widok 3D. Daje wyniki podobne do stereoskopowego mikroskopu świetlnego. Najlepsza rozdzielczość SEM w 2011 roku wynosiła 0,4 nanometra.
Mikroskopy elektronowe wyposażone w spektroskopię rentgenowską mogą zapewnić jakościową i ilościową analizę elementarną. Ten typ mikroskopu elektronowego, znany również jako analityczny mikroskop elektronowy, może być bardzo potężnym narzędziem do badania nanomateriałów.
Mikroskopia z sondą skanującą
Jest to technika subdyfrakcji. Przykładami mikroskopów z sondą skanującą są mikroskop sił atomowych (AFM), skaningowy mikroskop tunelowy , fotoniczny mikroskop siłowy i mikroskop śledzący rekurencję . Wszystkie tego typu metody wykorzystują fizyczny kontakt stałej końcówki sondy do skanowania powierzchni obiektu, który ma być prawie płaski.
Siła ultradźwiękowa
Ultradźwiękowa mikroskopia sił (UFM) została opracowana w celu poprawy szczegółów i kontrastu obrazu na „płaskich” obszarach zainteresowania, w których kontrast obrazów AFM jest ograniczony. Połączenie AFM-UFM umożliwia wygenerowanie obrazu mikroskopu akustycznego bliskiego pola. Końcówka AFM służy do wykrywania fal ultradźwiękowych i pokonuje ograniczenia długości fali występujące w mikroskopii akustycznej. Wykorzystując zmiany sprężystości pod końcówką AFM, można wygenerować obraz o znacznie większej szczegółowości niż topografia AFM.
Mikroskopia sił ultradźwiękowych umożliwia lokalne mapowanie sprężystości w mikroskopii sił atomowych poprzez zastosowanie drgań ultradźwiękowych do wspornika lub próbki. Aby przeanalizować wyniki ultradźwiękowej mikroskopii siłowej w sposób ilościowy, wykonuje się pomiar krzywej siła-odległość z drganiami ultradźwiękowymi przyłożonymi do podstawy wspornika, a wyniki porównuje się z modelem dynamiki wspornika i interakcji końcówka-próbka opartym na technika różnic skończonych.
Mikroskopia ultrafioletowa
Mikroskopy ultrafioletowe mają dwa główne cele. Pierwszym z nich jest wykorzystanie krótszej długości fali ultrafioletowej energii elektromagnetycznej w celu poprawy rozdzielczości obrazu poza granicę dyfrakcji standardowych mikroskopów optycznych. Ta technika jest używana do nieniszczącej kontroli urządzeń o bardzo małych cechach, takich jak te, które można znaleźć w nowoczesnych półprzewodnikach. Drugim zastosowaniem mikroskopów UV jest wzmacnianie kontrastu, w którym reakcja poszczególnych próbek jest wzmocniona w stosunku do ich otoczenia, dzięki interakcji światła z cząsteczkami w samej próbce. Jednym z przykładów jest wzrost kryształów białka . Kryształy białek tworzą się w roztworach soli. Ponieważ zarówno kryształy soli, jak i białka powstają w procesie wzrostu i oba są zwykle przezroczyste dla ludzkiego oka, nie można ich rozróżnić za pomocą standardowego mikroskopu optycznego. Ponieważ tryptofan białka pochłania światło o długości fali 280 nm, obrazowanie za pomocą mikroskopu UV z filtrami pasmowymi 280 nm ułatwia rozróżnienie między dwoma typami kryształów. Kryształy białka wydają się ciemne, podczas gdy kryształy soli są przezroczyste.
Mikroskopia w podczerwieni
Termin mikroskopia w podczerwieni odnosi się do mikroskopii wykonywanej w zakresie fal podczerwonych . W typowej konfiguracji instrumentu spektrometr podczerwieni z transformacją Fouriera (FTIR) jest połączony z mikroskopem optycznym i detektorem podczerwieni . Detektor podczerwieni może być detektorem jednopunktowym, układem liniowym lub układem płaszczyzny ogniskowej 2D. FTIR zapewnia możliwość wykonywania analiz chemicznych za pomocą spektroskopii w podczerwieni a mikroskop i detektor punktowy lub macierzowy umożliwiają przestrzenną rozdzielczość tej analizy chemicznej, tj. przeprowadzenie jej w różnych obszarach próbki. W związku z tym technika ta jest również nazywana mikrospektroskopią w podczerwieni. Alternatywna architektura zwana obrazowaniem laserowym w podczerwieni (LDIR) polega na połączeniu regulowanego źródła światła podczerwonego i detektora jednopunktowego na latającym celu. Ta technika jest często używana do chemicznego obrazowania w podczerwieni , gdzie kontrast obrazu jest określany przez reakcję poszczególnych regionów próbki na określone długości fal IR wybranych przez użytkownika, zwykle określone pasma absorpcji IR i związane z nimi rezonanse molekularne . Kluczowym ograniczeniem konwencjonalnej mikrospektroskopii w podczerwieni jest to, że rozdzielczość przestrzenna jest ograniczona przez dyfrakcję . W szczególności rozdzielczość przestrzenna jest ograniczona do liczby związanej z długością fali światła. W przypadku praktycznych mikroskopów IR rozdzielczość przestrzenna jest ograniczona do 1-3x długości fali, w zależności od konkretnej techniki i używanego instrumentu. Dla długości fali średniej podczerwieni wyznacza to praktyczny limit rozdzielczości przestrzennej ~ 3-30 μm.
Istnieją również wersje IR mikroskopii subdyfrakcyjnej. Obejmują one skaningowy mikroskop optyczny bliskiego pola w podczerwieni (NSOM) , mikrospektroskopię fototermiczną i spektroskopię w podczerwieni opartą na mikroskopie sił atomowych (AFM-IR) , a także skaningową mikroskopię optyczną bliskiego pola typu rozpraszania (s-SNOM) i nano-FTIR, które zapewniają rozdzielczość przestrzenną w nanoskali przy długościach fal IR.
Cyfrowa mikroskopia holograficzna

W cyfrowej mikroskopii holograficznej (DHM) interferujące czoła fal ze spójnego (monochromatycznego) źródła światła są rejestrowane na czujniku. Obraz jest cyfrowo rekonstruowany przez komputer z zarejestrowanego hologramu . Oprócz zwykłego obrazu w jasnym polu tworzony jest obraz z przesunięciem fazowym .
DHM może pracować zarówno w trybie odbicia, jak i transmisji. W trybie odbicia obraz przesunięcia fazowego zapewnia pomiar odległości względnej, a tym samym przedstawia mapę topografii powierzchni odbijającej. W trybie transmisji obraz z przesunięciem fazowym zapewnia ilościowy pomiar grubości optycznej próbki bez etykiet. Obrazy komórek biologicznych z przesunięciem fazowym są bardzo podobne do obrazów wybarwionych komórek i zostały pomyślnie przeanalizowane za pomocą do analizy o dużej zawartości .
Unikalną cechą DHM jest możliwość regulacji ostrości po zarejestrowaniu obrazu, ponieważ wszystkie płaszczyzny ostrości są rejestrowane jednocześnie przez hologram. Ta funkcja umożliwia obrazowanie poruszających się cząstek w objętości lub szybkie skanowanie powierzchni. Kolejną atrakcyjną cechą jest możliwość DHM do korzystania z niedrogiej optyki poprzez korygowanie aberracji optycznych za pomocą oprogramowania.
Patologia cyfrowa (mikroskopia wirtualna)
Patologia cyfrowa to środowisko informacyjne oparte na obrazie, które umożliwia technologia komputerowa, która umożliwia zarządzanie informacjami generowanymi na podstawie slajdu cyfrowego. Patologia cyfrowa jest częściowo możliwa dzięki wirtualnej mikroskopii , która jest praktyką przekształcania szklanych preparatów w preparaty cyfrowe, które można przeglądać, zarządzać nimi i analizować.
Mikroskopia laserowa
Mikroskopia laserowa to szybko rozwijająca się dziedzina, która wykorzystuje źródła oświetlenia laserowego w różnych formach mikroskopii. Na przykład mikroskopia laserowa skoncentrowana na zastosowaniach biologicznych wykorzystuje o ultrakrótkich impulsach w wielu technikach określanych jako mikroskopia nieliniowa, mikroskopia nasycenia i mikroskopia ze wzbudzeniem dwufotonowym .
Od kilku lat trwają prace nad laboratoryjnymi laserami rentgenowskimi o wysokiej intensywności i krótkim impulsie . Kiedy ta technologia dojdzie do skutku, możliwe będzie uzyskiwanie powiększonych trójwymiarowych obrazów elementarnych struktur biologicznych w stanie żywym w ściśle określonej chwili. Aby uzyskać optymalny kontrast między wodą a białkiem oraz najlepszą czułość i rozdzielczość, laser należy dostroić w pobliżu linii azotu na około 0,3 nanometra. Rozdzielczość będzie ograniczona głównie przez ekspansję hydrodynamiczną, która zachodzi podczas rejestracji niezbędnej liczby fotonów. Tak więc, podczas gdy próbka jest niszczona przez ekspozycję, jej konfigurację można uchwycić, zanim eksploduje. [ nadmierne cytowania ]
Naukowcy pracowali nad praktycznymi projektami i prototypami holograficznych mikroskopów rentgenowskich, pomimo przedłużającego się opracowywania odpowiedniego lasera. [ nadmierne cytowania ]
Mikroskopia fotoakustyczna
Technika mikroskopowa wykorzystująca efekt fotoakustyczny , czyli generowanie (ultra)dźwięków w wyniku pochłaniania światła. Skoncentrowana i modulowana intensywność wiązki laserowej jest skanowana rastrowo nad próbką. Wygenerowany (ultra)dźwięk jest wykrywany przez przetwornik ultradźwiękowy. Powszechnie stosowane są ultradźwiękowe przetworniki piezoelektryczne.
absorpcji próbki . Kontrastuje to z mikroskopią jasnego lub ciemnego pola, w której kontrast obrazu wynika z przepuszczalności lub rozpraszania. Zasadniczo kontrast mikroskopii fluorescencyjnej jest również proporcjonalny do absorpcji próbki. Jednak w mikroskopii fluorescencyjnej wydajność kwantowa fluorescencji zero, aby można było wykryć sygnał Jednak w mikroskopii fotoakustycznej każda substancja pochłaniająca daje sygnał fotoakustyczny do
Tutaj współczynnikiem Grüneisena a próbki Dlatego mikroskopia fotoakustyczna wydaje się dobrze pasować jako technika uzupełniająca mikroskopię fluorescencyjną, ponieważ wysoka wydajność kwantowa fluorescencji prowadzi do wysokich sygnałów fluorescencyjnych, a niska wydajność kwantowa fluorescencji prowadzi do wysokich sygnałów fotoakustycznych.
Pomijając efekty nieliniowe, rozdzielczość poprzeczna dx jest ograniczona granicą dyfrakcji Abbego :
gdzie długością fali lasera wzbudzającego, a jest aperturą numeryczną soczewki obiektywu. Granica dyfrakcji Abbego obowiązuje, jeśli nadchodzące czoło fali jest równoległe. W rzeczywistości jednak profil wiązki laserowej jest gaussowski. Dlatego w celu obliczenia osiągalnej rozdzielczości należy zastosować wzory na ucięte wiązki Gaussa.
Mikroskopia amatorska
Mikroskopia amatorska to badanie i obserwacja próbek biologicznych i niebiologicznych w celach rekreacyjnych. Kolekcjonerzy minerałów , owadów , muszli i roślin mogą używać mikroskopów jako narzędzi do odkrywania cech, które pomagają im klasyfikować ich zebrane przedmioty. Inni amatorzy mogą być zainteresowani obserwacją życia znalezionego w wodzie stawowej i innych próbkach. Mikroskopy mogą się również przydać do oceny jakości wody dla osób prowadzących domowe akwarium. Dodatkową przyjemnością jest dokumentacja fotograficzna i rysowanie obrazów mikroskopowych. Istnieją konkursy na fotomikrograficzną . Uczestnicy tej zabawy mogą skorzystać z komercyjnie przygotowanych szkiełek mikroskopowych lub przygotować je samodzielnie.
Chociaż mikroskopia jest głównym narzędziem w dokumentacji próbek biologicznych, często nie wystarcza do uzasadnienia opisu nowego gatunku na podstawie samych badań mikroskopowych. Często do potwierdzenia odkrycia nowego gatunku niezbędne są badania genetyczne i biochemiczne. Laboratorium literatury naukowej to konieczność. Jest jednak jedna przewaga, jaką amatorzy mają nad profesjonalistami: czas na poznanie otoczenia. Często zaawansowani amatorzy łączą siły z profesjonalistami, aby zweryfikować swoje odkrycia i być może opisać nowe gatunki.
Pod koniec XIX wieku mikroskopia amatorska stała się popularnym hobby w Stanach Zjednoczonych i Europie. Filantropom opłacano kilku „zawodowych amatorów” za ich wyprawy w celu pobierania próbek i eksploracji mikroskopowych, aby zapewnić im rozrywkę w niedzielne popołudnie (np. specjalista od okrzemek A. Grunow, opłacany przez (między innymi) belgijskiego przemysłowca). Profesor John Phin opublikował „Praktyczne wskazówki dotyczące wyboru i użycia mikroskopu (wydanie drugie, 1878)”, a także był redaktorem „American Journal of Microscopy”.
Przykłady amatorskich obrazów mikroskopowych:
Zastosowanie w kryminalistyce
Mikroskopia ma zastosowanie w naukach sądowych. Mikroskop może wykrywać, rozdzielać i obrazować najmniejsze dowody, często bez jakiejkolwiek zmiany lub zniszczenia. Mikroskop służy do identyfikowania i porównywania włókien, włosów, gleby i kurzu… itd.
W przypadku oznaczeń tuszem, plam krwi lub kul nie jest wymagana żadna obróbka próbki, a dowody wynikają bezpośrednio z badania mikroskopowego. W przypadku śladów określonej materii przygotowanie próbki należy wykonać przed badaniem mikroskopowym. [ wymagane wyjaśnienie ]
Mikroskopy świetlne są najczęściej używane w kryminalistyce, wykorzystując fotony do tworzenia obrazów, mikroskopy, które są najbardziej odpowiednie do badania próbek kryminalistycznych, to:
1. Mikroskop złożony
2. Mikroskop porównawczy
3. Mikroskop stereoskopowy
4. Mikroskop polaryzacyjny
5. Mikrospektrofotometr
Ta różnorodność typów mikroskopów w zastosowaniach kryminalistycznych wynika głównie z ich zakresów powiększeń, które wynoszą (1-1200X), (50-30 000X) i (500-250 000X) odpowiednio dla mikroskopii optycznej, SEM i TEM.
Zobacz też
- Akronimy w mikroskopii
- Mikroskop cyfrowy
- Cyfrowa patologia
- Mikroskopia z cyklerem obrazowym
- Korekta nieskończoności
- Mikroskopia interferometryczna
- Oświetlenie Köhlera
- Lista mikroskopistów
- Mikrodensytometr
- Kalendarium technologii mikroskopowej
- Mikroskopia wzbudzenia dwufotonowego
- Mikroskop USB
- mikroskopy Van Leeuwenhoeka
- Mikroskopijne odkrycie życia drobnoustrojów przez Van Leeuwenhoeka (mikroorganizmy)
Dalsza lektura
- Pluta, Maksymilian (1988). Zaawansowana mikroskopia świetlna tom. 1 Zasady i podstawowe właściwości . Elsevier. ISBN 978-0-444-98939-0 .
- Pluta, Maksymilian (1989). Zaawansowana mikroskopia świetlna tom. 2 Metody specjalistyczne . Elsevier. ISBN 978-0-444-98918-5 .
- Bradbury, S.; Bracegirdle, B. (1998). Wprowadzenie do mikroskopii świetlnej . Wydawcy naukowi BIOS . ISBN 978-0-387-91515-9 .
- Inoue, Shinya (1986). Mikroskopia wideo . Prasa plenum. ISBN 978-0-306-42120-4 .
- Cremer, C.; Cremer, T. (1978). „Rozważania na temat laserowego mikroskopu skanującego o wysokiej rozdzielczości i głębi ostrości” (PDF) . Microscopica Acta . 81 (1): 31–44. PMID 713859 . Teoretyczne podstawy mikroskopii superrozdzielczości 4Pi i projekt konfokalnego laserowego skaningowego mikroskopu fluorescencyjnego
- Willis, Randall C. (2007). „Portrety życia, jedna cząsteczka na raz” . Chemia analityczna . 79 (5): 1785–8. doi : 10.1021/ac0718795 . PMID 17375393 . , artykuł fabularny na temat mikroskopii subdyfrakcyjnej z wydania Analytical Chemistry z 1 marca 2007
Linki zewnętrzne
Ogólny
- Glosariusz mikroskopii , Terminy powszechnie używane w amatorskiej mikroskopii świetlnej.
- Nikon MicroscopyU Obszerne informacje na temat mikroskopii świetlnej
- Centrum zasobów mikroskopii mikroskopowej Olympus
- Carl Zeiss „Mikroskopia od samego początku” , samouczek krok po kroku dotyczący podstaw mikroskopii.
- Mikroskopia w szczegółach — zasób z wieloma ilustracjami opisującymi najczęstsze techniki mikroskopii
- Manawatu Microscopy - pierwsze znane środowisko współpracy do mikroskopii i analizy obrazu.
- Glosariusz mikroskopu audio
Techniki
- Zastosowania obrazowania ratiometrycznego dla mikroskopów Przykłady obrazowania ratiometrycznego Praca na mikroskopie
- Interaktywna baza danych barwników i filtrów fluorescencyjnych Carl Zeiss Interaktywna baza danych barwników i filtrów fluorescencyjnych.
- Nowe podejście do mikroskopii Eric Betzig: Poza Nagrodą Nobla — nowe podejście do mikroskopii.