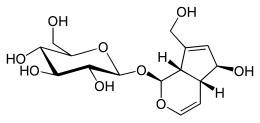
Aukubin
|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
(1S , 4aR , 5S , 7aS ) -5-hydroksy-7-(hydroksymetylo)-1,4a,5,7a-tetrahydrocyklopenta[ c ]piran-1-ylo β- D -glukopiranozyd
|
|
|
Preferowana nazwa IUPAC
(2S , 3R , 4S , 5S , 6R ) -2-{[(1S , 4aR , 5S , 7aS ) -5-hydroksy-7-(hydroksymetylo)-1,4a,5 ,7a-tetrahydrocyklopenta[ c ]piran-1-ylo]oksy}-6-(hydroksymetylo)oksano-3,4,5-triol |
|
| Inne nazwy Aukubin
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 50340 | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.006.856 |
| Numer WE |
|
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C15H22O9 _ _ _ _ _ | |
| Masa cząsteczkowa | 346,332 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Aukubina jest glikozydem irydoidowym . Irydoidy są powszechnie spotykane w roślinach i działają jako związki obronne. Irydoidy zmniejszają tempo wzrostu wielu ogólnych roślinożerców.
Zjawiska naturalne
Aucubin, podobnie jak inne irydoidy , występuje w asteridach , takich jak Aucuba japonica (Garryaceae), Eucommia ulmoides (Eucommiaceae), Plantago asiatica , Plantago major , Plantago lanceolata (Plantaginaceae), Galium aparine (Rubiaceae) i inne. Rośliny te są wykorzystywane w tradycyjnej medycynie chińskiej i ludowej.
Agnusyd składa się z aukubiny i kwasu p -hydroksybenzoesowego .
Efekty zdrowotne
Stwierdzono, że aukubina chroni przed uszkodzeniem wątroby wywołanym przez tetrachlorek węgla lub alfa-amanitynę u myszy i szczurów, gdy dootrzewnowo podawano 80 mg/kg.
Chemia
Aucubin jest związkiem na bazie monoterpenoidów. Aucubin, podobnie jak wszystkie irydoidy, ma szkielet cyklopentan-[C]-piran. Irydoidy mogą składać się z dziesięciu, dziewięciu lub rzadko ośmiu atomów węgla, w których częściej brakuje C11 niż C10. Aucubin ma 10 atomów węgla z brakiem węgla C11. Konfiguracje stereochemiczne w C5 i C9 prowadzą do skondensowanych pierścieni cis, które są wspólne dla wszystkich irydoidów zawierających karbocykliczny lub seco-szkielet w postaci nieprzegrupowanej. Rozszczepienie oksydacyjne przy wiązaniu C7-C8 daje sekoirydoidy. Ostatnie etapy biosyntezy irydoidów obejmują zwykle O -glikozylację i O -alkilację. Aukubina, irydoid glikozydowy, ma ugrupowanie glukozy połączone wiązaniem O.
Biosynteza
Pirofosforan geranylu (GPP) jest prekursorem irydoidów. Fosforan geranylu jest wytwarzany na szlaku mewalonianu lub szlaku fosforanu metyloerytrytolu. Początkowe etapy szlaku obejmują fuzję trzech cząsteczek acetylo-CoA w celu wytworzenia związku C6 3-hydroksy-3-metyloglutarylo-CoA (HMG-CoA). HMG-CoA jest następnie redukowany w dwóch etapach przez enzym reduktazę HMG-CoA. Powstały mewalonian jest następnie sekwencyjnie fosforylowany przez dwie oddzielne kinazy, kinazę mewalonianową i kinazę fosfomewalonianową, z wytworzeniem 5-pirofosfomewalonianu. Dekarboksylaza fosfomewalonianu poprzez skoordynowaną reakcję dekarboksylacji daje pirofosforan izopentenylu (IPP). IPP jest podstawowym budulcem C5, który jest dodawany do kosubstratów fosforanu prenylu w celu utworzenia dłuższych łańcuchów. IPP jest izomeryzowany do estru allilowego pirofosforanu dimetyloallilu (DMAPP) przez izomerazę IPP. Poprzez wieloetapowy proces, w tym defosforylację, DMAPP, IPP i DMAPP są łączone, tworząc związek C10 pirofosforan geranylu (GPP). Pirofosforan geranylu jest głównym punktem rozgałęzienia terpenoidów .
Obecny [ kiedy? ] badania biosyntezy sugerują, że najbardziej prawdopodobna syntetyczna sekwencja od 10-hydroksygerinolu do 8- epi -iriotrialu jest następująca: defosforylacja GPP prowadzi do kationu geranylu, który jest następnie hydroksylowany z wytworzeniem 10-hydroksygeraniolu; 10-hydroksylgeraniol jest izomeryzowany do 10-hydroksynerolu; 10-hydroksynerol jest utleniany przy użyciu NAD z wytworzeniem trialdehydu; ostatecznie trialdehyd przechodzi podwójną addycję Michaela, dając 8-epi-irydotrial. 8-Epi-irydotrial jest kolejnym pośrednim punktem rozgałęzienia.
Reakcja cyklizacji prowadząca do utworzenia pierścienia piranowego irydoidu może wynikać z jednej z dwóch dróg:
- droga 1 – wodorkowy atak nukleofilowy na C1 doprowadzi do ataku atomu 1- O -karbonylu na C3, dając pierścień laktonowy;
- droga 2 – utrata protonu z węgla 4 prowadzi do powstania wiązania podwójnego C3-C4; w konsekwencji atom 3- O -karbonylu przyłączy się do C1.
Na podstawie badań śledzenia deuteru szlak biosyntezy aubucyny z cyklizowanego laktonu pośredniego jest specyficzny dla organizmu. W Gardenia jasminoides cyklizowany lakton pośredni jest glikozylowany z wytworzeniem boschnalozydu, który jest następnie hydroksylowany na C10; boschnalozyd jest utleniany do kwasu geniposidowego ; kwas geniposydowy jest następnie dekarboksylowany, tworząc bartyzyzyd; bartyzyzyd jest następnie hydroksylowany z wytworzeniem aukubiny. Scrophularia umbrosa różni się od Gardenia jasminoides . U Scrophularia umbrosa pośredni lakton jest glikozylowany i utleniany przy karbonylu C11 z wytworzeniem kwasu 8-epi-deksoiloganowego, który następnie przekształca się w kwas deoksygeniposydowy; kwas dezoksygeniposydowy jest hydroksylowany przy C10 do kwasu geniposydowego; dekarboksylacja i hydroksylacja C6 prowadzi do aubucyny.
- ^ a b Nieminen M; Suomi J; Van Nouhuys S (2003). „Wpływ zawartości glikozydów irydoidowych na wybór rośliny żywicielskiej do składania jaj i pasożyta u specjalistycznego roślinożercy”. J. Chem. eko . 29 (4): 823–843. doi : 10.1023/A:1022923514534 . PMID 12775146 . S2CID 16553547 .
- ^ Puttick G, Bowers M (1998). „Wpływ zmienności jakościowej i ilościowej allelochemikaliów na ogólnego owada: glikozydy irydoidowe i robaka południowego”. J. Chem. eko . 14 (1): 335–351. doi : 10.1007/BF01022550 . PMID 24277013 . S2CID 28710791 .
- ^ Suh N, Shim C, Lee M, Kim S, Chung I (1991). „Badanie farmakokinetyczne glukozydu irydoidowego: Aukubina”. Badania Farmaceutyczne . 08 (8): 1059–1063. doi : 10.1023/A:1015821527621 . PMID 1924160 . S2CID 24135356 .
- Bibliografia _ Pokonaj Meiera i Otto Stichera (wrzesień – październik 2000). „Analityczna metoda wysokosprawnej chromatografii cieczowej do oznaczania zawartości agnuzydu i kwasu p-hydroksybenzoesowego we fruktozie Agni-casti”. Analiza fitochemiczna . 11 (5): 327–329. doi : 10.1002/1099-1565(200009/10)11:5<327::AID-PCA523>3.0.CO;2-0 .
- ^ Yang K, Kwon S, Choe H, Yun H, Chang I (1983). „Ochronne działanie Aucuba japonica przed uszkodzeniami carbontetrackmkxmms u szczurów”. Lek Chemia. Toksykol . 6 (5): 429–441. doi : 10.3109/01480548309014165 . PMID 6628265 .
- ^ a b c d e f g h Sampio-Santos M, Kaplan M (2001). „Znaczenie biosyntezy irydoidów w chemosystematyce” . J. Braz. chemia soc . 12 (2): 144–153. doi : 10.1590/S0103-50532001000200004 .
- ^ El-Naggar L, Beal J (1980). „Irydoidy: przegląd”. J. Nat. prod . 43 (6): 649–707. doi : 10.1021/np50012a001 . PMID 20707392 .
- ^ a b c d e f g h i j McGarbey, D; Croteau R (1995). „Metabolizm terpenoidów” . Komórka Roślinna . 7 (3): 1015–26. doi : 10.1105/tpc.7.7.1015 . PMC 160903 . PMID 7640522 .
- ^ Nangia A, Prasuna G, Rao P (1997). „Synteza cyklopenta [c] piranowego szkieletu laktonów irydoidowych”. czworościan . 53 (43): 14507–14545. doi : 10.1016/S0040-4020(97)00748-5 .
- ^ Damtoft S, Jensen S, Jessen C, Knudsen T (1993). „Późne etapy biosyntezy aukubiny w Scrophularia”. Fitochemia . 35 (5): 1089–1093. doi : 10.1016/0031-9422(93)85028-P .