Bromek złota(III).

|
|

|
|
| Nazwy | |
|---|---|
| Inne nazwy Bromek aury Bromek złota Bromek złota(III) Trójbromek złota Heksabromek digoldu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.030.582 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| 3 sierpnia | |
| Masa cząsteczkowa | 436,679 g · mol -1 |
| Wygląd | ciemnoczerwone do czarnych kryształów |
| Temperatura topnienia | 97,5 ° C (207,5 ° F; 370,6 K) |
| Słabo rozpuszczalny | |
| Zagrożenia | |
| NFPA 704 (ognisty diament) | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Bromek złota (III) jest ciemnoczerwonym do czarnego krystalicznym ciałem stałym. Ma wzór empiryczny AuBr 3 , ale występuje głównie jako dimer o wzorze cząsteczkowym Au 2 Br 6 , w którym dwa atomy złota są połączone mostkiem przez dwa atomy bromu. Jest powszechnie określany jako bromek złota (III), tribromek złota i rzadko, ale tradycyjnie bromek aury, a czasami jako heksabromek digoldu. Podobnie jak w przypadku innych halogenków złota, związek ten jest wyjątkowy, ponieważ jest kompleksem koordynacyjnym grupy 11 metal przejściowy, który jest stabilny na stopniu utlenienia +3, podczas gdy kompleksy miedzi lub srebra utrzymują się na stopniu utlenienia +1 lub +2.
Historia
Pierwsza wzmianka o jakichkolwiek badaniach lub studiach nad halogenkami złota pochodzi z okresu od początku do połowy XIX wieku i jest trzech głównych badaczy związanych z szeroko zakrojonymi badaniami tej konkretnej dziedziny chemii: Thomsen, Schottländer i Krüss.
Struktura
Dimer, heksabromek digoldu, ma właściwości strukturalne podobne do innych dimerycznych związków trihalogenku złota, takich jak chlorek złota (III) . Złote centra wykazują kwadratową płaską koordynację z kątami wiązań około 90 stopni.
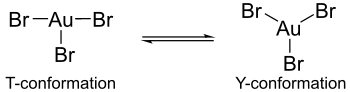
Obliczenia wskazują, że w hipotetycznych monomerycznych formach trihalogenków złota efekt Jahna-Tellera powoduje powstawanie różnic w strukturach kompleksów halogenków złota. Na przykład bromek złota(III) zawiera jedno długie i dwa krótkie wiązania złoto-brom, podczas gdy chlorek złota(III) i fluorek złota(III) składają się z dwóch długich i jednego krótkiego wiązania złoto-halogen. Co więcej, tribromek złota nie wykazuje takiej samej koordynacji wokół centralnego atomu złota, jak trichlorek złota lub trifluorek złota. W tych ostatnich kompleksach koordynacja wykazuje konformację T, ale w tribromku złota koordynacja istnieje jako bardziej dynamiczna równowaga między konformacją Y a konformacją T. Tę różnicę w koordynacji można przypisać efektowi Jahna-Tellera, ale bardziej zmniejszeniu Wiązanie zwrotne π atomów złota z ligandami bromu w porównaniu z wiązaniem zwrotnym π znalezionym w przypadku ligandów fluoru i chloru. Jest to również ten spadek wiązania wstecznego π, który wyjaśnia, dlaczego tribromek złota jest mniej stabilny niż jego odpowiedniki trifluorkowe i trichlorkowe.
Przygotowanie
Najpowszechniejszą metodą syntezy bromku złota(III) jest ogrzewanie złota i nadmiaru płynnego bromu w temperaturze 140°C:
- 2 Au + 3 Br 2 → Au 2 Br 6
Alternatywnie, reakcja wymiany halogenkowej chlorku złota (III) z kwasem bromowodorowym również okazała się skuteczna w syntezie bromku złota (III):
- Au2Cl6 + 6 HBr → 6 HCl + Au2Br6
Ta reakcja jest napędzana wytwarzaniem stosunkowo bardziej stabilnego kwasu chlorowodorowego w porównaniu z kwasem bromowodorowym .
Właściwości chemiczne
Obojętny monomer AuBr 3 , podobnie jak inne obojętne formy trihalogenku złota, nie został wyizolowany w fazie gazowej, co wskazuje, że trzecia koordynacja nie jest uprzywilejowana. Przeważnie złoto (III) wykazuje kwadratową koordynację płaską odpowiadającą preferowanej liczbie koordynacyjnej równej cztery.
W szczególności trihalogenki złota (III) w roztworze mają tendencję do dodawania czwartego ligandu, tworząc bardziej korzystny kompleks o czterech współrzędnych. Jeśli chodzi o tribromek złota , często kupuje się hydrat bromku złota(III), bezwodną AuBr3 ·H2O , w którym centralny atom złota wykazuje liczbę koordynacyjną równą cztery, a nie postać związku, która wykazuje liczbę koordynacyjną liczba trzy.
Alternatywnie, jeśli nie ma dodatku czwartego liganda, tribromek złota będzie oligomeryzował, tworząc wspomniany wcześniej kompleks dimeru z mostkiem halogenowym.
- 2 AuBr 3 → Au 2 Br 6
Ponadto, podobnie jak chlorek złota (III) , tribromek złota jest kwasem Lewisa i może tworzyć kilka kompleksów. Na przykład w obecności kwasu bromowodorowego dimer rozpuszcza się i powstaje kwas bromoaurynowy.
- HBr(aq) + AuBr 3 (aq) → H + [AuBr 4 ] - (aq)
Dimer również ulega szybkiej hydrolizie w wilgotnym powietrzu.
Używa
Chemia katalityczna
Bromek złota (III) jest używany jako katalizator w różnych reakcjach, ale jedno z jego najciekawszych zastosowań znajduje się w reakcji Dielsa-Aldera . Konkretnie, związek katalizuje reakcję między jednostką enynalową a karbonylowymi , tworząc sześcioczłonowy cykliczny związek.
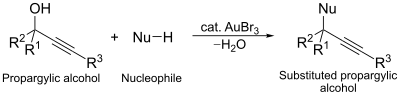
Innym katalitycznym zastosowaniem tribromku złota jest reakcja podstawienia nukleofilowego alkoholi propargilowych. W tej reakcji kompleks złota działa jako środek aktywujący alkohol, ułatwiający podstawienie.
Wykrywanie ketaminy
Bromek złota(III) może być użyty jako odczynnik testowy na obecność ketaminy .
0,25% AuBr 3 0,1 M NaOH, aby uzyskać brązowawo-żółty roztwór. Dwie krople tego są dodawane do płytki do plamienia i dodaje się niewielką ilość ketaminy. Mieszanina daje ciemnofioletowy kolor w ciągu około jednej minuty, który zmienia się w ciemny, czarno-fioletowy kolor w ciągu około dwóch minut.
Acetaminofen , kwas askorbinowy , heroina , laktoza , mannitol , morfina i sacharoza powodują natychmiastową zmianę koloru na fioletowy, podobnie jak inne związki z grupami fenolowymi i hydroksylowymi.
Nic powszechnie spotykanego w połączeniu z ketaminą nie dawało takiej samej zmiany koloru w tym samym czasie.
„Początkowy fioletowy kolor może być spowodowany tworzeniem się kompleksu między złotem a ketaminą. Przyczyna zmiany koloru z fioletowego na ciemny czarno-purpurowy jest nieznana, jednak może to być spowodowane reakcją redoks, która wytwarza niewielka ilość złota koloidalnego ”.