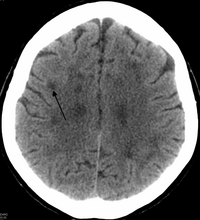
Dziedziczna rozlana leukoencefalopatia z sferoidami
Dziedziczna rozlana leukoencefalopatia z sferoidami ( HDLS ) jest rzadką chorobą autosomalną dominującą , która rozpoczyna się u dorosłych i charakteryzuje się zwyrodnieniem istoty białej mózgu z demielinizacją i sferoidami aksonalnymi , co prowadzi do postępującej dysfunkcji funkcji poznawczych i motorycznych. Sferoidy to zgrubienia aksonalne z nieciągłymi lub nieobecnymi mielinowymi . Uważa się, że choroba wynika z pierwotnej dysfunkcji mikrogleju, która prowadzi do wtórnego zakłócenia integralności aksonów, uszkodzenia neuroaksonów i ogniskowych sferoid aksonalnych prowadzących do demielinizacja . Sferoidy w HDLS przypominają do pewnego stopnia te wytwarzane przez naprężenia ścinające w zamkniętym urazie głowy z uszkodzeniem aksonów, powodując ich puchnięcie z powodu zablokowania transportu aksoplazmatycznego . Oprócz urazów sferoidy aksonalne można znaleźć w starzejącym się mózgu, udarze i innych chorobach zwyrodnieniowych. W HDLS nie jest pewne, czy demielinizacja występuje przed sferoidami aksonalnymi lub co wyzwala neurodegenerację po pozornie prawidłowym rozwoju mózgu i istoty białej, chociaż deficyty genetyczne sugerują, że demielinizacja i patologia aksonalna mogą być wtórne do dysfunkcji mikrogleju. Zespół kliniczny u pacjentów z HDLS nie jest specyficzny i można go pomylić z chorobą Alzheimera , otępieniem czołowo-skroniowym , atypowym parkinsonizmem , stwardnieniem rozsianym lub zwyrodnienie korowo-podstawne .
Objawy
Z objawami zmian osobowości, zmian behawioralnych, demencji , depresji i epilepsji, HDLS jest często błędnie diagnozowany w przypadku wielu innych chorób. Na przykład otępienie lub zmiany w zachowaniu czołowo-skroniowym często skłaniają niektórych klinicystów do błędnego brania pod uwagę diagnoz, takich jak choroba Alzheimera, otępienie czołowo-skroniowe lub atypowy parkinsonizm. Obecność zmian w istocie białej doprowadziła do błędnej diagnozy stwardnienia rozsianego. HDLS często objawia się neuropsychiatrycznymi , przechodzącymi w otępienie, a po kilku latach objawia się dysfunkcjami motorycznymi. W końcu pacjenci stają się zdani na wózki inwalidzkie.
Zwyrodnienie istoty białej jest związane z innymi leukodystrofiami rozpoczynającymi się u dorosłych, takimi jak leukodystrofia metachromatyczna (MLD), choroba Krabbego (leukodystrofia komórek globoidalnych) i adrenoleukodystrofia sprzężona z chromosomem X (X-ADL).
| Choroba | Ekskluzywna cecha |
|---|---|
| MLD | Akumulacja materiału metachromatycznego w istocie białej |
| Choroba Krabbego | Obecność globoidalnych komórek pochodzących z mikrogleju, które mają wiele jąder |
| X-ALD | Dominująca nieprawidłowość istoty białej ciemieniowo-potylicznej |
| Choroba zanikającej istoty białej (VWM). |
|
| Nasu-Hakola |
|
Objawy neuropsychiatryczne
W badaniach klinicznych pacjentów z HDLS zidentyfikowano wiele objawów neuropsychiatrycznych. Należą do nich ciężka depresja i lęk, które zostały zidentyfikowane w około 70% rodzin HDLS, graniczące z tendencjami samobójczymi i nadużywaniem substancji, takich jak alkoholizm . Dodatkowo pacjenci mogą wykazywać dezorientację, splątanie, pobudzenie, drażliwość, agresywność, zmieniony stan psychiczny, utratę zdolności wykonywania wyuczonych ruchów ( apraksja ) lub niemożność mówienia ( mutyzm ).
Upośledzenie ruchowe
U osób z HDLS mogą wystąpić drżenia, zmniejszona ruchomość ciała, niestabilność ( parkinsonizm , mięśnie po jednej stronie ciała w ciągłym skurczu ( niedowład połowiczy spastyczny ), upośledzenie funkcji motorycznych i czuciowych kończyn dolnych ( niedowład kończyn dolnych ), porażenie prowadzące do częściowego lub całkowitego utrata wszystkich kończyn i tułowia ( tetrapareza ) oraz brak dobrowolnej koordynacji ruchów mięśni ( ataksja ).
Powoduje
Przyczyną HDLS w większości rodzin jest mutacja receptora czynnika stymulującego kolonie 1 (CSF1R), czynnika wzrostu dla mikrogleju i monocytów/makrofagów, co sugeruje, że dysfunkcja mikrogleju może być podstawowa w HDLS.
Mutacje koncentrują się w domenie kinazy tyrozynowej (TKD) białka. Mutacje stwierdzono głównie w eksonach 12-22 wewnątrzkomórkowego TKD , w tym 10 mutacji zmiany sensu , które mają delecję pojedynczego nukleotydu i delecję pojedynczego kodonu, która składa się z trypletu nukleotydów, które zostały usunięte, co powoduje, że cały aminokwas nie jest kodowany. Ponadto zidentyfikowano trzy mutacje miejsca składania , które spowodowały usunięcie egzonu w ramce , eksprymowana sekwencja nukleotydowa, prowadząca do usunięcia ponad 40 aminokwasów w TKD.
Określenie to oparto na badaniach genetycznych 14 rodzin HDLS potwierdzających mutacje w tym genie. Białko receptora CSF1 działa przede wszystkim w regulacji, przeżywalności, proliferacji i różnicowaniu komórek mikrogleju. Mechanizm dysfunkcji mikrogleju z powodu mutacji w CSF1R do utraty mieliny i tworzenia sferoid aksonów pozostaje nieznany. Potrzebne są dalsze badania, aby lepiej zrozumieć patogenezę choroby .
Patologia
W HDLS dochodzi do powiększenia komór bocznych i wyraźnego ścieńczenia lub osłabienia istoty białej mózgu. Utrata istoty białej jest spowodowana mieliny . Zmiany te są związane z rozlaną gliozą , umiarkowaną utratą aksonów i wielu sferoid aksonalnych.
Aktywowany lub ameboidalny mikroglej i makrofagi , które zawierają resztki mieliny, kropelki lipidów i brązowe autofluorescencyjne granulki pigmentu, znajdują się w obszarach z demielinizacją i sferoidami aksonalnymi. Na silnie zdegenerowanych obszarach występuje wiele dużych, reaktywnych astrocytów wypełnionych włókienkami glejowymi .
W przypadkach sekcji zwłok wykazano, że nieprawidłowości istoty białej są stosunkowo ograniczone do mózgu, z pominięciem móżdżku i wielu głównych włókien układu nerwowego. Wyjątkiem są drogi korowo-rdzeniowe (drogi piramidalne) w pniu mózgu i czasami w rdzeniu kręgowym .
Patologia mózgu HDLS przypomina chorobę Nasu-Hakola (policystyczna osteodysplazja tłuszczowo-błoniasta ze stwardniającą leukoencefalopatią).
Diagnoza
Badania od 2012 roku obejmują badania funkcji mikrogleju. Ta praca dodatkowo wyjaśniłaby, czy choroba jest przede wszystkim defektem funkcji mikrogleju. Do takiego badania komórki mikrogleju z pokrewnych HDLS można hodować z mózgu z sekcji zwłok i analizować w porównaniu z normalnymi komórkami mikrogleju na podstawie różnic w występowaniu mutacji i ekspresji czynnika wzrostu.
Diagnostyka różnicowa
Powiązane zaburzenia w tym samym spektrum chorób, co HDLS, obejmują chorobę Nasu-Hakola ( policystyczna lipobłoniasta osteodysplazja z leukoencefalopatią stwardniającą ) oraz rodzaj leukodystrofii z makrofagami wypełnionymi pigmentem, zwany pigmentową ortochromatyczną leukodystrofią (POLD). Oprócz choroby istoty białej Nasu-Hakola powoduje torbiele kości. Jest to spowodowane mutacjami w genach zaangażowanych w tę samą kaskadę szlaku sygnałowego czynnika stymulującego kolonie (CSF) , jak zidentyfikowano w HDLS.
Wydaje się, że choroba Nasu-Hakola jest spowodowana mutacjami w białku wiążącym kinazę tyrozynową TYRO ( TYROBP – znanym również jako DAP12) lub w receptorze wyzwalającym wyrażanym na komórkach mieloidalnych 2 ( TREM2 ) białko. Podczas gdy różne mutacje genów występują w szlaku Nasu-Hakola i HDLS, obie charakteryzują się degeneracją istoty białej z aksonalnymi sferoidami. Obecni badacze w tej dziedzinie uważają, że bardziej dogłębna analiza i porównanie dwóch nieprawidłowości genetycznych w tych zaburzeniach może doprowadzić do lepszego zrozumienia mechanizmów chorobowych w tych rzadkich zaburzeniach. POLD wykazuje niezapalną demielinizację aksonów z początkowymi objawami euforii, apatii, bólu głowy i dysfunkcji wykonawczych . Podczas gdy HDLS jest autosomalnie dominujący, niektóre rodziny z POLD mają cechy sugerujące dziedziczenie autosomalne recesywne. Niemniej jednak ostatnio wykazano, że POLD ma takie same podstawy genetyczne jak HDLS.
Badania kliniczne i genealogiczne
Aby lepiej zrozumieć chorobę, naukowcy dokonali retrospektywnego przeglądu dokumentacji medycznej probantów i innych osób, które zostały ocenione za pomocą badań klinicznych lub kwestionariuszy. Próbki krwi są pobierane od rodzin probantów do badań genetycznych. Ci członkowie rodziny są oceniani na podstawie ich standardowej historii medycznej , progresji objawów podobnych do choroby Parkinsona ( Ujednolicona Skala Oceny Choroby Parkinsona ) oraz progresji upośledzenia funkcji poznawczych, takich jak demencja ( test Folsteina ).
Neuroobrazowanie
Standardowe skany MRI przeprowadzono na skanerach 1,5 Tesli o grubości 5 mm i odstępach 5 mm w celu przeszukiwania zmian w istocie białej w zidentyfikowanych rodzinach. Jeśli intensywność sygnału skanów MRI jest wyższa w obszarach istoty białej niż w obszarach istoty szarej, uważa się, że pacjent jest zagrożony HDLS, chociaż wiele innych zaburzeń może również powodować zmiany w istocie białej, a wyniki nie są diagnostyczne bez genetycznej test lub potwierdzenie patologiczne .
Patologia
Skrawki tkanek z biopsji mózgu lub mózgów z sekcji zwłok są zwykle zatapiane w parafinie , z której wycina się skrawki i umieszcza na szkiełkach do badań histologicznych. Specjalne barwniki do mieliny i patologii aksonalnej pokazują nieprawidłowe zmiany charakterystyczne dla HDLS w istocie białej kory nowej , jąder podstawy , wzgórza , śródmózgowia , mostu i rdzenia kręgowego. Oprócz rutynowych histologicznych ( barwienie H&E ) próbki ocenia się za pomocą immunohistochemia dla ubikwityny , białka prekursorowego amyloidu i neurofilamentu w celu scharakteryzowania zmian aksonalnych i podstawowego białka mieliny w patologii mieliny. Barwienie immunohistochemiczne mikrogleju (CD68 lub HLA-DR) i astrocytów (GFAP) jest również pomocną techniką charakteryzowania patologii istoty białej. Z patologią podobną do POLD, HDLS jest zwykle grupowany jako leukoencefalopatia rozpoczynająca się w wieku dorosłym z sferoidami aksonalnymi i glejem barwnikowym (ALSP), aby zwrócić większą uwagę na te indywidualnie niedoceniane stany.
Klasyfikacja
HDLS należy do kategorii chorób istoty białej mózgu zwanych leukoencefalopatiami, które charakteryzują się pewnym stopniem dysfunkcji istoty białej. HDLS ma uszkodzenia istoty białej z nieprawidłowościami w otoczce mielinowej wokół aksonów, gdzie wpływy przyczynowe są stale badane w oparciu o ostatnie odkrycia genetyczne. Badania przeprowadzone przez Sundala i współpracowników ze Szwecji wykazały, że allel ryzyka u rasy kaukaskiej może być przyczyną, ponieważ dotychczas zidentyfikowane przypadki dotyczyły dużych rodzin rasy kaukaskiej.
Kierownictwo
Epidemiologia
Średni profil kliniczny z opublikowanych badań pokazuje, że mediana wieku zachorowania pacjentów z HDLS wynosi 44,3 lat, średni czas trwania choroby wynosi 5,8 lat, a średni wiek zgonu 53,2 lat. Od 2012 roku zidentyfikowano około 15 przypadków z co najmniej 11 sporadycznymi przypadkami HDLS. Przypadki HDLS zostały zlokalizowane w Niemczech, Norwegii, Szwecji i Stanach Zjednoczonych, co wskazuje na międzynarodową dystrybucję skupiającą się między Europą Północną a Stanami Zjednoczonymi.
Poprzez badanie wielu pokrewnych stwierdzono, że choroba nie występowała tylko wśród mężczyzn lub kobiet, ale raczej była równomiernie rozłożona, co wskazuje na autosomalne, a nie związane z płcią zaburzenie genetyczne . Zaobserwowano również, że przypadki HDLS nie pomijały pokoleń, jak miałoby to miejsce w przypadku dziedziczenia recesywnego, i jako takie zostały oznaczone jako autosomalne dominujące.
Historia
Choroba ta została po raz pierwszy opisana w 1984 roku przez Axelssona i in. w dużym szwedzkim rodowodzie. Jest to zaburzenie lepiej znane neuropatologom niż klinicystom. Neuropatolog zainteresowany HDLS, dr Dennis W. Dickson, zidentyfikował szereg przypadków z neuropatologicznych mózgów przesłanych do zbadania rodzinnej demencji wieku dorosłego i zaburzeń ruchowych w Nowym Jorku, a później na Florydzie. Uznanie znaczenia tego zaburzenia jako przyczyny demencji i zaburzeń ruchu w wieku dorosłym zostało jeszcze bardziej wzmocnione w 1997 r. w Klinice Mayo kiedy dr Zbigniew K. Wszołek zidentyfikował rodzinę z HDLS, co początkowo uważano za spowodowane innym procesem chorobowym (FTDP-17), ale dopiero sekcja zwłok jednego , a następnie innych członków rodziny wykazała, że jest to HDLS. Wszołek założył międzynarodowe konsorcjum w 2005 roku w celu zidentyfikowania innych rodzin i pobrania próbek DNA lub mózgu od członków rodziny w celu potwierdzenia neuropatologicznego i badań genetycznych w Mayo Clinic na Florydzie.