Elektroforeza białek surowicy
| Elektroforeza białek surowicy | |
|---|---|
 Schemat normalnej elektroforezy białek surowicy z legendą różnych stref.
| |
| MeSH | |

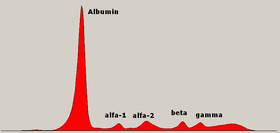
Elektroforeza białek surowicy ( SPEP lub SPE ) to test laboratoryjny, który bada określone białka we krwi zwane globulinami . Najczęstszymi wskazaniami do testu elektroforezy białek surowicy są diagnoza lub monitorowanie mnogiego , gammapatii monoklonalnej o niepewnym znaczeniu (MGUS) lub dalsze badanie rozbieżności między niskim poziomem albuminy a stosunkowo wysokim poziomem białka całkowitego. Niewyjaśniony ból kości, niedokrwistość, białkomocz , przewlekła choroba nerek i hiperkalcemia są również objawami szpiczaka mnogiego i wskazaniami do SPE. Najpierw należy pobrać krew , zwykle do hermetycznej fiolki lub strzykawki . Elektroforeza jest techniką laboratoryjną, w której surowicę krwi (płynną część krwi po skrzepnięciu krwi) nakłada się na membranę octanową nasączoną płynnym buforem lub na zbuforowaną matrycę żelu agarozowego lub na ciecz w kapilarze rury i wystawiony na działanie prądu elektrycznego w celu rozdzielenia składników białkowych surowicy na pięć głównych frakcji według wielkości i ładunku elektrycznego: albuminy surowicy , globuliny alfa-1 , globuliny alfa-2 , globuliny beta 1 i 2 oraz globuliny gamma .
Elektroforeza octanowa lub żelowa
Białka są rozdzielane zarówno przez siły elektryczne, jak i siły elektroendoosmostyczne. Ładunek netto białka jest oparty na sumie ładunku jego aminokwasów i pH buforu. Białka nakłada się na stałą matrycę, taką jak żel agarozowy lub membranę z octanu celulozy w ciekłym buforze, i przykłada się prąd elektryczny. Białka o ładunku ujemnym będą migrować w kierunku dodatnio naładowanej anody. Albumina ma najbardziej ujemny ładunek i będzie migrować najdalej w kierunku anody. Przepływ endoosmotyczny to ruch cieczy w kierunku katody, który powoduje cofanie się białek o słabszym ładunku od miejsca aplikacji. Białka gamma są rozdzielane głównie przez siły endoosmotyczne.
Elektroforeza kapilarna
W elektroforezie kapilarnej nie ma stałej matrycy. Białka rozdzielane są przede wszystkim przez silne siły elektroendosmotyczne. Próbka jest wstrzykiwana do kapilary z ujemnym ładunkiem powierzchniowym. Stosowany jest wysoki prąd, a ujemnie naładowane białka, takie jak albumina, próbują przesunąć się w kierunku anody. Ciekły bufor przepływa w kierunku katody i ciągnie białka o słabszym ładunku.
Frakcje białek surowicy
Albumina
Albumina jest główną frakcją w normalnym SPEP. Konieczny jest spadek o 30%, zanim spadek pojawi się na elektroforezie. Zwykle widać pojedynczy zespół. heterozygotyczne mogą wytwarzać bisalbuminemię – dwa jednakowo wybarwione prążki, produkt dwóch genów. Niektóre warianty powodują powstanie szerokiego pasma lub dwóch pasm o nierównej intensywności, ale żaden z tych wariantów nie jest związany z chorobą. Zwiększona ruchliwość anodowa wynika z wiązania bilirubiny , niezestryfikowanych kwasów tłuszczowych , penicyliny i kwasu acetylosalicylowego , a czasami z trawienia trypsyną w ostrym zapaleniu trzustki . [ potrzebne źródło ]
Nieobecność albuminy, znana jako analbuminemia , jest rzadka. Jednak obniżony poziom albumin jest powszechny w wielu chorobach, w tym w chorobach wątroby , niedożywieniu , złym wchłanianiu, nefropatii z utratą białka i enteropatii.
Albumina – strefa międzystrefowa alfa-1
Nawet zabarwienie w tej strefie jest spowodowane lipoproteiną alfa-1 ( lipoproteina o wysokiej gęstości – HDL). Zmniejszenie występuje w ciężkich stanach zapalnych, ostrym zapaleniu wątroby i marskości wątroby . Również zespół nerczycowy może prowadzić do obniżenia poziomu albumin; z powodu jego utraty z moczem przez uszkodzony nieszczelny kłębuszek nerkowy . Wzrost pojawia się u ciężkich alkoholików oraz u kobiet w czasie ciąży iw okresie dojrzewania. [ potrzebne źródło ]
Wysoki poziom AFP , który może wystąpić w raku wątrobowokomórkowym , może skutkować ostrym pasmem między albuminą a strefą alfa-1. [ potrzebne źródło ]
Strefa alfa-1
Orosomukoid i antytrypsyna migrują razem, ale orosomukoid słabo się wybarwia, więc alfa 1 antytrypsyna (AAT) stanowi większość prążka alfa-1. Alfa-1 antytrypsyna posiada grupę SG, a związki tiolowe mogą wiązać się z białkiem zmieniając ich ruchliwość. Zmniejszony prążek jest widoczny w stanie niedoboru. Jest zmniejszona w zespole nerczycowym , a jej brak może wskazywać na możliwy niedobór alfa 1-antytrypsyny. To ostatecznie prowadzi do rozedmy płuc z nieuregulowanej aktywności elastazy neutrofili w tkance płucnej. Frakcja alfa-1 nie zanika jednak w niedoborze alfa 1-antytrypsyny, ponieważ migrują tam również inne białka, w tym alfa- lipoproteina i orosomukoid. Jako dodatni odczynnik ostrej fazy, AAT wzrasta w ostrym zapaleniu. [ potrzebne źródło ]
Białko Bence-Jonesa może wiązać się i opóźniać pasmo alfa-1. [ potrzebne źródło ]
Międzystrefa alfa-1 – alfa-2
Można zobaczyć dwa słabe prążki reprezentujące alfa 1-antychymotrypsynę i białko wiążące witaminę D. Pasma te łączą się i nasilają we wczesnym zapaleniu z powodu wzrostu alfa 1-antychymotrypsyny, białka ostrej fazy . [ potrzebne źródło ]
Strefa alfa-2
Strefa ta składa się głównie z makroglobuliny alfa-2 (AMG lub A2M) i haptoglobiny . Zwykle występują niskie poziomy w niedokrwistości hemolitycznej (haptoglobina jest cząsteczką samobójczą, która wiąże się z wolną hemoglobiną uwalnianą z krwinek czerwonych i kompleksy te są szybko usuwane przez fagocyty ). Haptoglobina jest podnoszona jako część odpowiedzi ostrej fazy, co powoduje typowe podwyższenie strefy alfa-2 podczas stanu zapalnego. Normalna strefa alfa-2 i podwyższona strefa alfa-1 to typowy wzorzec przerzutów do wątroby i marskość wątroby.
Kompleksy haptoglobina/hemoglobina migrują bardziej katodowo niż haptoglobina, jak widać w międzystrefie alfa-2 – beta. Jest to zwykle postrzegane jako poszerzenie strefy alfa-2.
Makroglobulina alfa-2 może być podwyższona u dzieci i osób starszych. Jest to postrzegane jako ostry front pasma alfa-2. AMG jest znacznie podwyższone (wzrost 10-krotny lub większy) w związku z utratą białka kłębuszkowego, jak w zespole nerczycowym . Ze względu na swój duży rozmiar AMG nie może przechodzić przez kłębuszki nerkowe, podczas gdy inne białka o niższej masie cząsteczkowej są tracone. Zwiększona synteza AMG odpowiada za bezwzględny wzrost zespołu nerczycowego. Zwiększone AMG obserwuje się również u szczurów bez albuminy, co wskazuje, że jest to odpowiedź na niski poziom albuminy, a nie sam zespół nerczycowy
AMG jest nieznacznie podwyższone we wczesnym przebiegu nefropatii cukrzycowej . [ potrzebne źródło ]
Alfa-2 - strefa międzystrefowa beta
Nierozpuszczalna na zimno globulina tworzy tutaj pasmo, którego nie widać w osoczu , ponieważ jest wytrącane przez heparynę . Niski poziom występuje w stanach zapalnych, a wysoki w czasie ciąży. [ potrzebne źródło ]
Beta-lipoproteina tworzy w tej strefie nieregularne karbowane pasmo. Wysokie poziomy obserwuje się w hipercholesterolemii typu II , hipertriglicerydemii i zespole nerczycowym.
Strefa beta
Transferyna i beta-lipoproteina ( LDL ) obejmuje beta-1. Podwyższony poziom białka beta-1 z powodu zwiększonego poziomu wolnej transferyny jest typowy dla niedokrwistości z niedoboru żelaza , ciąży i terapii estrogenowej . Zwiększone stężenie białka beta-1 spowodowane podwyższeniem LDL występuje w hipercholesterolemii . Zmniejszone stężenie białka beta-1 występuje w ostrym lub przewlekłym zapaleniu. [ potrzebne źródło ]
Beta-2 zawiera C3 ( białko dopełniacza 3). Wzrasta w odpowiedzi ostrej fazy. Depresja C3 występuje w zaburzeniach autoimmunologicznych, gdy układ dopełniacza jest aktywowany, a C3 wiąże się z kompleksami immunologicznymi i jest usuwany z surowicy. Fibrynogen, białko beta-2, występuje w normalnym osoczu, ale nie występuje w normalnej surowicy. Czasami krew pobrana od pacjentów leczonych heparyną nie krzepnie całkowicie, co skutkuje widocznym prążkiem fibrynogenu między globulinami beta i gamma. [ potrzebne źródło ]
Strefa międzystrefowa beta-gamma
Białko C-reaktywne znajduje się pomiędzy strefami beta i gamma, wytwarzając fuzję beta/gamma. IgA ma największą ruchliwość anodową i zwykle migruje w obszarze między strefami beta i gamma, powodując również fuzję beta/gamma u pacjentów z marskością wątroby, infekcją dróg oddechowych, chorobami skóry lub reumatoidalnym zapaleniem stawów (podwyższony poziom IgA). Fibrynogen z osocza próbki będą widoczne w regionie beta gamma. Fibrynogen, białko beta-2, występuje w normalnym osoczu, ale nie występuje w normalnej surowicy. Czasami krew pobrana od pacjentów leczonych heparyną nie krzepnie całkowicie, co skutkuje widocznym prążkiem fibrynogenu między globulinami beta i gamma. [ potrzebne źródło ]
Strefa gammy
Immunoglobuliny lub przeciwciała są na ogół jedynymi białkami obecnymi w normalnym regionie gamma . Warto zauważyć, że każde białko migrujące w regionie gamma zostanie zabarwione i pojawi się na żelu, co może obejmować zanieczyszczenia białkowe, artefakty lub niektóre leki. W zależności od tego, czy stosowana jest metoda agarozowa, czy kapilarna, zakłócenia są różne. Immunoglobuliny składają się z łańcuchów ciężkich (μ, δ, γ, α i ε) oraz łańcuchów lekkich (κ i λ). Normalna strefa gamma powinna wyglądać jak gładki rumieniec lub smuga, bez asymetrii i ostrych pików. Stężenie gamma globulin może być podwyższone ( hipergammaglobulinemia ), obniżone ( hipogammaglobulinemia ) lub mają nieprawidłowy szczyt lub szczyty. Należy zauważyć, że immunoglobuliny można znaleźć również w innych strefach; IgA zwykle migruje w strefie beta-gamma, aw szczególności patogenne immunoglobuliny mogą migrować w dowolnym miejscu, w tym w regionach alfa. [ potrzebne źródło ]
Hipogammaglobulinemia jest łatwa do zidentyfikowania jako „załamanie” lub zmniejszenie strefy gamma. To normalne u niemowląt. Występuje u pacjentów z z chromosomem X. Niedobór IgA występuje u 1:500 populacji, na co wskazuje bladość w strefie gamma. Warto zauważyć, że hipogammaglobulinema może być postrzegana w kontekście MGUS lub szpiczaka mnogiego. [ potrzebne źródło ]
Jeśli strefa gamma wykazuje wzrost, pierwszym krokiem w interpretacji jest ustalenie, czy obszar jest wąski, czy szeroki. Szeroki „spuchnięty” sposób (szeroki) wskazuje na wytwarzanie immunoglobulin poliklonalnych. Jeśli jest podwyższony w sposób asymetryczny lub z jednym lub kilkoma szczytami lub wąskimi „kolcami”, może to wskazywać na klonalną produkcję jednej lub więcej immunoglobulin,
Gammopatia poliklonalna jest wskazywana przez „spuchnięte” podwyższenie w strefie gamma, co zazwyczaj wskazuje na stan nienowotworowy (chociaż nie dotyczy wyłącznie stanów nienowotworowych). Najczęstszymi przyczynami hipergammaglobulinemii poliklonalnej wykrywanej za pomocą elektroforezy są ciężkie zakażenia , przewlekła choroba wątroby, reumatoidalne zapalenie stawów, toczeń rumieniowaty układowy i inne choroby tkanki łącznej. [ potrzebne źródło ]
Wąski kolec sugeruje gammapatię monoklonalną, znaną również jako ograniczone pasmo lub „kolec M”. Aby potwierdzić, że ograniczonym prążkiem jest immunoglobulina, przeprowadza się dalsze testy z immunofiksacją lub immunoprzemieszczeniem/immunosubstrakcją (metodami kapilarnymi). Terapeutyczne przeciwciała monoklonalne (mAb), również migrują w tym regionie i mogą być błędnie interpretowane jako gammapatia monoklonalna i mogą być również identyfikowane przez immunofiksację lub immunoprzemieszczenie/immunosubtrakcję, ponieważ są one strukturalnie porównywalne z ludzkimi immunoglobulinami. Najczęstszą przyczyną ograniczonego prążka jest MGUS (gammapatia monoklonalna o niepewnym znaczeniu), która, chociaż jest koniecznym prekursorem, rzadko rozwija się w szpiczaka mnogiego. (Średnio 1% rocznie.) Zazwyczaj gammapatia monoklonalna jest pochodzenia złośliwego lub klonalnego, a szpiczak jest najczęstszą przyczyną skoków IgA i IgG . przewlekła białaczka limfatyczna i lymphosarcoma nie są rzadkością i zwykle powodują powstawanie paraprotein IgM . Należy zauważyć, że do 8% zdrowych pacjentów w podeszłym wieku może mieć impuls monoklonalny. Makroglobulinemia Waldenströma (IgM), gammapatia monoklonalna o nieokreślonym znaczeniu (MGUS), amyloidoza, białaczka z komórek plazmatycznych i samotne plazmocytomy również powodują M-spike.
Na gammopatię oligoklonalną wskazuje jeden lub więcej odrębnych klonów. [ potrzebne źródło ]
Lizozym może być postrzegany jako pasmo katodowe do gamma w białaczce mielomonocytowej , w której jest uwalniany z komórek nowotworowych . [ potrzebne źródło ]
Linki zewnętrzne
- Elektroforeza białek w Lab Tests Online
