egzopolifosfataza
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| egzopolifosfatazy | |||||||||
| nr WE | 3.6.1.11 | ||||||||
| nr CAS | 9024-85-5 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Egzopolifosfataza (PPX) jest enzymem fosfatazy , który katalizuje hydrolizę nieorganicznego polifosforanu , liniowej cząsteczki złożonej z do 1000 lub więcej monomerów połączonych wiązaniami fosfo-bezwodnikowymi. PPX jest procesową egzofosfatazą, co oznacza, że zaczyna się na końcach łańcucha polifosforanowego i rozszczepia wiązania fosfo-bezwodnika, uwalniając ortofosforan , gdy porusza się on wzdłuż cząsteczki polifosforanu. PPX ma kilka cech, które odróżniają go od innych znanych polifosfataz, a mianowicie to, że nie działa na ATP , ma silną preferencję dla długołańcuchowych polifosforanów i ma bardzo niskie powinowactwo do cząsteczek polifosforanów zawierających mniej niż 15 monomerów fosforanowych.
PPX odgrywa ważną rolę w metabolizmie fosforanów i energii we wszystkich organizmach żywych. Jest to szczególnie ważne dla utrzymania odpowiedniego poziomu wewnątrzkomórkowego polifosforanu , który bierze udział w różnych funkcjach komórkowych, w tym w odpowiedzi na czynniki stresogenne, takie jak niedobory aminokwasów , ortofosforanów lub azotu , zmiany pH , obniżenie poziomu składników odżywczych i wysoki poziom soli, oraz jako nieorganiczny chaperon molekularny . PPX jest klasyfikowany jako polifosfataza, która jest częścią dużej rodziny fosfoesteraz DHH. Obie podrodziny w tej nadrodziny mają wspólne cztery N-końcowe , ale mają różne ugrupowania C-końcowe .
Aktywność PPX oznacza się ilościowo przez pomiar utraty znakowanego radioaktywnie polifosforanu 32P . PPX miesza się ze znaną ilością znakowanego polifosforanu, a reakcję hydrolizy zatrzymuje kwasem nadchlorowym (HClO4 ) . Następnie mierzy się ilość pozostałego znakowanego polifosforanu przez cieczowe zliczanie scyntylacyjne .
Historia
PPX został odkryty przez laboratorium laureata Nagrody Nobla Arthura Kornberga w 1993 roku i jest częścią operonu polifosforanowego wraz z kinazą polifosforanową , enzymem syntetyzującym polifosforan . Laboratorium Kornberg było bardzo zainteresowane polifosforanami i opublikowało serię artykułów wyjaśniających metabolizm i rolę polifosforanów in vivo . Zainteresowanie polifosforanami doprowadziło ich do zidentyfikowania i scharakteryzowania operonu polifosforanowego (który obejmuje kinazę polifosforanową [PPK] i PPX) oraz opracowania szerokiej gamy testów i technik ilościowego oznaczania produkcji i degradacji polifosforanów, in vitro i in vivo . Wyniki tych badań polifosforanów przeprowadzonych przez laboratorium Kornberga skłoniły Kornberga do spekulacji, że ze względu na wysoką zawartość energii i fosforanów oraz stopień, w jakim jest konserwowany u różnych gatunków, polifosforan mógł być prekursorem RNA , DNA i białek .
Struktura
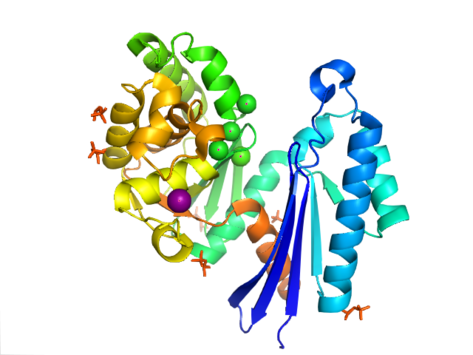
Struktura PPX charakteryzuje się podobną do aktyny domeną ATPazy , która jest częścią tej nadrodziny. W Aquifex aeolicus zawiera motyw podobny do rybonukleazy H, który składa się z pięcioniciowej β -kartki z drugą nicią antyrównoległą do reszty. Kilka nici jest połączonych segmentami helikalnymi, które są dłuższe w domenie C-końcowej niż w domenie N-końcowej. Pięć helis alfa znajduje się w domenie C-końcowej, a tylko dwie w domenie N-końcowej. Zamknięta konfiguracja enzymu jest określana jako struktura typu I. Ta konfiguracja ma podobne cechy jak inni członkowie tej nadrodziny, w tym domeny N-końcowe i C-końcowe oddzielone dwiema helisami alfa wyśrodkowanymi w strukturze. Bardziej otwarty układ domen przedstawia ruch obrotowy dwóch domen wokół pojedynczego regionu zawiasowego. Elastyczność strukturalna została opisana jako „podobny do motyla” otwór szczeliny wokół miejsca aktywnego .
W E. coli egzopolifosfataza występuje jako dimer , przy czym każdy monomer składa się z czterech domen. Pierwsze dwie domeny składają się z trzech arkuszy beta, po których następuje fałd alfa-beta-alfa-beta-alfa. Różni się to od poprzednio opisanego Aquifex aeolicus , któremu brakuje trzeciej i czwartej domeny. Do tej pory rozwiązano 4 struktury dla tej klasy enzymów, z kodami dostępu Protein Data Bank 1T6C , 1T6D , 1U6Z i 2FLO .
Aktywna strona
Miejsce aktywne egzopolifosfatazy znajduje się w szczelinach między domenami I i II. W E. coli region ten zawiera pętlę między niciami beta-1 i beta-2 z aminokwasami glutaminianem i asparaginianem (E121, D143 i E150). Reszty te, wraz z K197, są krytyczne dla wiązania fosforanów i jonów, co jest powszechnie spotykane wśród innych ASKHA (kinazy octanowe i cukrowe, Hsp70 , aktyna ). U A. aeolicus miejsce aktywne enzymu znajduje się w szczelinie między dwiema domenami. Widać, że katalityczne grupy karboksylowe w tej szczelinie są ważne dla aktywności enzymu, szczególnie Asp141 i Glu148. Preferencja egzopolifosfatazy do wiązania się z polifosforanem, a nie z ATP , przyczyniła się do starcia, które mogłoby wystąpić między rybozą i adenozyną ATP a łańcuchami bocznymi N21, C169 i R267.
Mechanizm
Egzopolifosfataza odszczepia końcowy fosforan z polifosforanu poprzez łańcuchy boczne aminokwasów glutaminianu i lizyny. Glutaminian aktywuje wodę, pozwalając jej działać jako nukleofil i atakować końcowy fosforan. Tlen, który poprzednio łączył dwa atomy fosforanu, następnie pobiera wodór z pobliskiej reszty lizyny.
Funkcjonować
Polifosforany są wykorzystywane przez enzymy egzopolifosfatazy, które rozszczepiają fragmenty łańcucha fosforanów. Białka te odgrywają istotną rolę w metabolizmie i utrzymaniu polifosforanów. Polifosforan znajduje się w całym cytozolu każdej komórki i jest również obecny w organellach komórkowych . Istnieje wiele klas egzopolifosfataz, z których każda ma swoją unikalną lokalizację i właściwości. Spekulowano, że po rozkładzie polifosforanów biorą udział w cząsteczkach sygnałowych działających jako drugorzędni przekaźniki . U E. coli regulacja metabolizmu polifosforanów jest słabo poznana.
Polifosforan to liniowy łańcuch fosforanów połączonych ze sobą wiązaniami bezwodnikowymi. Polifosforany występują we wszystkich żywych organizmach i odgrywają istotną rolę w ich przetrwaniu. W bakteriach polifosforan służy do magazynowania energii w celu zastąpienia trójfosforanu adenozyny . Wykazano również, że bierze udział w tworzeniu i funkcjonowaniu błony komórkowej, regulacji enzymów i kontroli transkrypcji genów. U ssaków polifosforany biorą udział w krzepnięciu krwi i stanach zapalnych, odpowiedzi immunologicznej, rozwoju tkanki kostnej i funkcjonowaniu mózgu.
drożdżowym wykazano, że zmutowane drożdże z niedoborem aktywności egzopolifosfatazy miały problemy z oddychaniem i metabolizmem nieorganicznych polifosforanów. I odwrotnie, wykazano, że szczepy drożdży, które mają wyższy poziom enzymu egzopolifosfatazy, nie mają oczywistych defektów wzrostu w warunkach niedoboru fosforanu lub nadmiaru fosforanu, jednak poziom polifosforanu w drożdżach był znacznie niższy z powodu zwiększonej liczby enzymów rozkładających łańcuchy polifosforanowe.
Potencjalne znaczenie kliniczne/przemysłowe
E. coli , które nie są w stanie syntetyzować polifosforanów, giną już po kilku dniach w fazie stacjonarnej . Strategie hamowania akumulacji polifosforanów w bakteriach są zatem interesujące jako potencjalne terapie przeciwbakteryjne. Można to osiągnąć poprzez hamowanie kinazy polifosforanowej, zwiększenie aktywności egzopolifosfatazy lub jedno i drugie.
Akumulacja polifosforanów jest również interesująca w różnych zastosowaniach przemysłowych, w tym w usuwaniu Pi ze środowisk wodnych poprzez ulepszone biologiczne usuwanie fosforu oraz ze względu na jego rolę jako molekularnego białka opiekuńczego w ekspresji rekombinowanego białka . Ze względu na aktywność polifosforanu jako białka opiekuńczego molekularnego, szczepy E. coli , które akumulują polifosforan, mogą być wykorzystane do zwiększenia wydajności rozpuszczalnego rekombinowanego białka .
Rekombinowana egzopolifosfataza z Saccharomyces cerevisiae chroni przed śmiertelnością i przywraca ochronne odpowiedzi immunologiczne w przedklinicznych modelach sepsy.