Halostachina
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
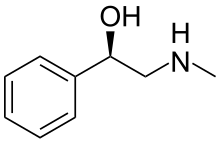
2-(Metyloamino)-1-fenyloetanol
|
|
| Inne nazwy
N -Metylofenyloetanoloamina; 1-hydroksy-1-fenylo-2-metyloaminoetan; alkohol α-(metyloaminometylo)benzylowy; 2-Metyloamino-1-fenyloetanol
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Numer WE |
|
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C9H13NO _ _ _ _ _ | |
| Masa cząsteczkowa | 151,209 g·mol -1 |
| Wygląd | Bezbarwne ciało stałe |
| Temperatura topnienia | 43 do 45 ° C (109 do 113 ° F; 316 do 318 K) (enancjomer R lub S); 75–76 ° C (racemat) |
| Zagrożenia | |
| Oznakowanie GHS : | |

|
|
| Ostrzeżenie | |
| H302 , H332 | |
| P261 , P264 , P270 , P271 , P301+P312 , P304+P312 , P304+P340 , P312 , P330 , P501 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Halostachina (znana również jako N -metylofenyloetanoloamina ) jest produktem naturalnym , alkaloidem wyizolowanym po raz pierwszy z azjatyckiego krzewu Halostachys caspica (synonim Halostachys belangeriana ) i strukturalnie β-hydroksyfenyloetyloaminą ( fenyloetanoloaminą ) spokrewnioną z jej lepiej znaną „macierzystą „ amina biogenna , fenyloetanoloamina , synefryna , lek adrenergiczny i alkaloid efedryna . Właściwości farmakologiczne halostachiny są w pewnym stopniu podobne do właściwości tych strukturalnie pokrewnych związków, a z Halostachys caspica zostały włączone jako składnik niektórych suplementów diety dostępnych bez recepty, ale halostachina nigdy nie została opracowana jako lek na receptę. Chociaż występuje w naturze jako pojedynczy stereoizomer , halostachina jest częściej dostępna jako produkt syntetyczny w postaci racematu ( patrz poniżej). Z wyglądu jest to bezbarwne ciało stałe.
Występowanie
Naturalnie występująca halostachina została po raz pierwszy odkryta przez Syrnevę w halofitycznej roślinie Halostachys caspica (obecnie klasyfikowana jako Halostachys belangeriana ) (rodzina Amaranthaceae). Błędna struktura pierwotnie zaproponowana dla tego związku została następnie poprawiona przez Mienszykowa i Rubinsteina.
Halostachine wyizolowano również z życicy trwałej Lolium perenne i kostrzewy trzcinowej Festuca arundinacea .
Obecność N -metylofenyloetanoloaminy w mózgu szczura została zasugerowana w doświadczeniach opisanych przez Saavedrę i Axelroda.
Chemia
Synteza
Na przestrzeni lat opublikowano kilka syntez racemicznej N -metylofenyloetanoloaminy. Synteza z wykorzystaniem „klasycznej” metodologii została opisana przez Durdena i współpracowników, zaczynając od acetofenonu . Grupę metylową acetofenonu bromowano bromem, otrzymując α -bromoacetofenon , który następnie poddano reakcji z N -metylobenzyloaminą, otrzymując amino-keton. Amino-keton zredukowano wodorkiem litowo-glinowym do odpowiedniego aminoalkoholu, a ostatecznie usunięto grupę N -benzylową przez katalityczne uwodornienie z użyciem katalizatora palladowego na węglu drzewnym.
Inna synteza, za sprawą Nordlandera i współpracowników, rozpoczęła się od acylowania benzenu przez Friedela-Craftsa chlorkiem N- (trifluoroacetylo)glicylu w obecności chlorku glinu . Otrzymany N- (trifluoroacetylo)-α-aminoacetofenon następnie N -metylowano jodkiem metylu i węglanem potasu , a produkt ostatecznie przekształcono w racemiczną N -metylofenyloetanoloaminę za pomocą borowodorku sodu w etanolu .
Wydajna, stereospecyficzna synteza halostachiny została opisana przez Zandbergena i współpracowników: ( R )-(+)-α-hydroksybenzenoacetonitryl został najpierw zabezpieczony O przy użyciu 2-metoksypropenu. Następnie produkt traktowano DIBAL , a następnie nieizolowaną iminę traktowano kolejno bromkiem amonu i metyloaminą w celu wywołania „transiminacji”. Powstała N -metyloimina została przekształcona w ( R )-(-)-α-[(metyloamino)metylo]benzenometanol (tj. ( R )-(-)-halostachina) z borowodorkiem sodu .
Nieruchomości
Pod względem chemicznym N -metylofenyetanoloamina jest związkiem aromatycznym , aminą i alkoholem . Grupa aminowa sprawia, że związek ten jest słabą zasadą , zdolną do reagowania z kwasami, tworząc sole.
Jedną z powszechnych soli N -metylofenyloetanoloaminy jest chlorowodorek (racemiczny), C9H13NO.HCl , t.t. 103-104 °C .
Wartość pKa chlorowodorku N - metylofenyloetanoloaminy w temperaturze 25°C i stężeniu 10 mM wynosi 9,29.
Obecność grupy hydroksylowej na benzylowej C cząsteczki N -metylofenyloetanoloaminy tworzy centrum chiralne , więc związek występuje w postaci dwóch enancjomerów , d- i l- N -metylofenyloetanoloaminy, lub jako mieszanina racemiczna , d, l- N -metylofenyloetanoloamina. Izomer prawoskrętny odpowiada konfiguracji S , a izomer lewoskrętny konfiguracji R.
że N - metylofenyloetanoloamina wyizolowana z Halostachys caspica i nazwana alkaloidem „halostachina” jest enancjomerem lewoskrętnym.
Halostachina ma temperaturę topnienia 43-45°C i [α] D = - 47,03°; chlorowodorek tego enancjomeru ma tt 113-114°C, a [α] D = -52,21°. Rozdzielenie racemicznej N -metylofenyloetanoloaminy za pomocą jej soli winianowych dało enancjomery o skręcalności właściwej [α] D = - 52,46° i + 52,78°.
Farmakologia
Pierwsze badanie farmakologiczne syntetycznej, racemicznej N -metylofenyloetanoloaminy (nazywanej przez tych autorów „metylofenyloetanoloaminą”) przeprowadzili Barger i Dale, którzy stwierdzili, że jest to presor o sile podobnej do fenyloetanoloaminy i β-fenyloetyloaminy w preparacie dla kotów. Następnie związek ten (nadal w postaci racematu) został dokładniej zbadany przez Chena i współpracowników, którzy potwierdzili jego działanie presyjne, ale zaobserwowali, że po podaniu dożylnym w preparacie dla kotów był on o około połowę silniejszy niż fenyloetanoloamina : całkowita dawka 5 x 10-6 M (lub ~ 1 mg soli HCl) spowodowała maksymalny wzrost ciśnienia krwi o 26 mm Hg. Dodatkowe eksperymenty przeprowadzone przez tych badaczy wykazały, że racemiczna N -metylofenyloetanoloamina również powodowała rozszerzenie źrenic w oku królika (wkroplenie kropli 0,05 M/l roztworu powodujące około 5-krotnie większe rozszerzenie niż ta sama dawka fenyloetanoloaminy), hamowanie izolowanych pasków jelita królika i skurcz izolowanej macicy świnki morskiej. Lek działał również ściągająco na błonę śluzową nosa.
U ludzi doustna dawka 50 mg nie miała wpływu na ciśnienie krwi, ale jest to tylko zgodne z jednym badaniem z 1929 roku.
Późniejsze badania przeprowadzone przez Landsa i Granta nad wpływem racemicznej N -metylofenyloetanoloaminy (zidentyfikowanej za pomocą kodów firmy Sterling-Winthrop „WIN 5529” lub „WIN 5529-2”) na ciśnienie krwi u nietkniętych psów dały wyniki podobne do uzyskanych przez Chen i in. al.: 0,41 mg/kg leku podane dożylnie powodowało wzrost ciśnienia krwi o 38 mm Hg trwający 3–10 minut. Efekt ten został opisany jako ~ 1/200 x większy niż wywołany tą samą dawką epinefryny (lub ~ 1/250 x w porównaniu molowym ) .
U owiec halostachina powodowała jedynie nieznaczne rozszerzenie źrenic w dawce 30 mg/kg iv i „pobudzenie” przy dawce 100 mg/kg; u świnek morskich dawki 30 mg/kg dootrzewnowo wywoływały niepokój trwający około 1/2 godziny, ale dawki 100 mg/kg dootrzewnowo powodowały pobudzenie, rozszerzenie źrenic, ślinotok, piloerekcję, drżenie mięśni oraz przyspieszenie akcji serca i oddechu, z powrót do normy po 1/2–2 godzinach.
Nowsze badania N -metylofenyloetanoloaminy (prawdopodobnie jako racematu) przeprowadzone przez Shannona i współpracowników potwierdziły i rozszerzyły wcześniejsze badania. Stwierdzono, że dożylne podanie leku psom w dawkach ~ 6 – 18 mg/kg powodowało znaczne rozszerzenie źrenic (100% zwiększenie średnicy źrenicy w wyniku podania dawki 17,5 mg/kg), efekt był nieco większy ( ~ 1,3 x) niż wytwarzane przez te same dawki fenyloetanoloaminy. N -Metylofenyloetanoloamina powodowała również zmniejszenie częstości akcji serca, które było odwrotnie proporcjonalne do dawki (tj. stopniowo większe dawki powodowały mniejszą bradykardię ), i która była ilościowo mniejsza niż ta wytwarzana przez te same dawki fenyloetanoloaminy. Lek powodował spadek temperatury ciała, który również był odwrotnie skorelowany z dawką i który był mniejszy niż ten, który powodowały te same dawki fenyloetanoloaminy. Dodatkowe objawy, które zaobserwowano, obejmowały obfite ślinienie i piloerekcję , chociaż w przeciwieństwie do fenyloetanoloaminy, N -metylofenyloetanoloamina nie powodowała żadnych stereotypowych ani szybkich ruchów gałek ocznych. Wyniki te skłoniły autorów do zasugerowania, że N -metylofenyloetanoloamina działała zarówno na α, jak i β receptory adrenergiczne .
Używając preparatu receptora β2 adrenergicznego pochodzącego z transfekowanych komórek HEK 293 , Liappakis i współpracownicy odkryli, że w receptorach typu dzikiego racemiczna N -metylofenyloetanoloamina (określana przez tych autorów jako „halostachina”) miała ~ 1/120 x powinowactwo epinefryny w eksperymentach współzawodnictwa z 3 [H]-CGP-12177, a zatem była około 3 razy silniejsza niż sama fenyloetanoloamina . Pomiary cAMP w nienaruszonych transfekowanych komórkach HEK 293, po traktowaniu EEDQ do dezaktywacji 98-99% receptorów wykazało, że „halostachina” była ~ 19% tak samo skuteczna jak epinefryna w maksymalnym stymulowaniu gromadzenia cAMP w receptorach typu dzikiego. „Halostachina” została zatem zinterpretowana jako posiadająca właściwości częściowego agonisty receptorów β2 .
Farmakodynamika
Farmakokinetyka N -metylofenyloetanoloaminy, po podaniu dożylnym psom, została zbadana przez Shannona i współpracowników, którzy stwierdzili, że lek działa zgodnie z „modelem dwuprzedziałowym”, z T1/2 (α ) ≃ 9,7 minuty i T1 /2 (β) ≃ 56,4 minuty; „okres półtrwania w osoczu” N -metylofenyloetanoloaminy wynosił zatem około 1 godziny.
Biochemia
W tkankach zwierzęcych N -metylofenyloetanoloamina powstaje w wyniku działania enzymu N -metylotransferazy fenyloetanoloaminy (PNMT), po raz pierwszy wyizolowanej z nadnerczy małpy przez Juliusa Axelroda , na fenyloetanoloaminę.
Działanie oksydaz monoaminowych MAO-A i MAO-B z mitochondriów mózgu szczura na N -metylofenyloetanoloaminę scharakteryzował Osamu i współpracownicy, którzy stwierdzili, że w stężeniu 10 μM związek ten (stereochemiczna tożsamość nieokreślona) był specyficznym substratem dla MAO-B, ale przy 100 μM i 1000 μM stał się substratem zarówno dla MAO-A, jak i MAO-B. Stałe kinetyczne podane przez tych badaczy były następujące: Km = 27,7 μM; Vmax 3,67 nM/mg białka/30 minut (wysokie powinowactwo) i Km = 143 μM; V max = 7,87 nM/mg białka/30 minut (niskie powinowactwo).
Toksyczność
LD50 N - metylofenyloetanoloaminy u myszy podano jako 44 mg/kg, iv i ~ 140 mg/kg, ip (racemiczny; sól HCl) .; we wcześniejszym artykule z tego samego roku Lands odnotowuje przybliżoną LD50 wynoszącą 490 mg/kg (mysz, dootrzewnowo) dla pozornie tego samego leku, ale zakodowanego jako „WIN 5529”, a nie „WIN 5529-2”.
Minimalna śmiertelna dawka racematu u królików, dożylnie, wynosi 100 mg/kg.
Badania przeprowadzone w celu ustalenia, czy halostachina może być odpowiedzialna za powodowanie „zataczania się życicy” w Australii, obejmowały podawanie dawek do 100 mg/kg dożylnie u owiec i 100 mg/kg dootrzewnowo u świnek morskich, bez żadnych wskazań śmiertelności. Chociaż najwyraźniej efekty adrenergiczne były widoczne u świnek morskich (patrz „Farmakologia” powyżej), badacze doszli do wniosku, że jest mało prawdopodobne, aby halostachina była przyczyną zespołu „zataczania się”.
Zobacz też
- ^ „Baza danych etykiet suplementów diety” . dietetyczne.nlm.nih.gov . Zarchiwizowane od oryginału w dniu 17 lutego 2013 r . . Źródło 2 lutego 2022 r .
- ^ „Halostachys caspica CAMey. - Lista roślin” .
- ^ YI Syrneva (1941). „Farmakologia nowego alkaloidu halostachiny”. Farmakologiya i Toksikologiya 4 45-51.
- ^ a b GP Menshikov i MM Rubinstein (1943). J. Gen. Chem. (ZSRR) 13 801.
- ^ a b c AJ Aasen, CCJ Culvenor, EP Finnie, AW Kellock i LW Smith (1969). „Alkaloidy jako możliwa przyczyna zataczania się życicy u zwierząt wypasanych”. Austr. J. Agric. Rez. 20 71-86.
- ^ LP Bush i JAD Jeffreys (1975). „Izolacja i separacja alkaloidów kostrzewy trzcinowej i życicy”. J.Chrom. 111 165-170.
- ^ a b JM Saavedra i J. Axelrod (1973). „Demonstracja i dystrybucja fenyloetanoloaminy w mózgu i innych tkankach”. proc. Natl. Acad. nauka USA 70 769-772.
- ^ ab . DA Durden, AV Juorio i BA Davis (1980) „Oznaczanie chromatografią cienkowarstwową i spektrometrią mas o wysokiej rozdzielczości β-hydroksyfenyloetyloamin w tkankach jako pochodnych dansylo-acetylowych”. Analny. chemia 52 1815-1820.
- ^ JE Nordlander, MJ Payne, FG Njoroge, MA Balk, GD Laikos i VM Vishwanath (1984). „Acylowanie Friedela-Craftsa chlorkami N-(trifluoroacetylo)-α-aminokwasów. Zastosowanie do wytwarzania β-aryloalkiloamin i 3-podstawionych 1,2,3,4-tetrahydroizochinolin”. J.Org. chemia 49 4107–4111.
- ^ P. Zandbergen, AMCH van den Niewendijk, J. Brussee, A. van der Gen i CG Kruse (1992). „Jednonaczyniowa synteza redukcyjno-transiminacyjno-redukowa N-podstawionych β-etanoloamin z cyjanohydryn”. Czworościan 48 3977-3982.
- ^ J. Armstrong i RB Barlow (1976). „Jonizacja amin fenolowych, w tym apomorfiny, dopaminy i katecholamin oraz ocena stałych jonu obojnaczego”. br. J. Pharmacol. 57 501–516.
- Bibliografia _ „Badania dyspersji rotacyjnej. I. Aralkiloaminy i alkohole”. J.Org. chemia 25 1779-1784.
- ^ R. Lukes, V. Dienstbierova, J. Kovar i K. Blaha (1961). "Uber die Konfiguration Stickstoffhaltiger Verbindungen. XII. Konfiguration des (-)- Halostachins." kol. Czech. chemia Kom. 26 466.
- ^ GP Mienszykow i GM Borodina (1947). J. Gen. Chem. (ZSRR) 17 1569.
- ^ G. Barger i HH Dale (1910). „Budowa chemiczna i sympatykomimetyczne działanie amin”. J. Physiol. 41 19-59.
- ^ a b c KK Chen, C.-K. Wu i E. Henriksen (1929). „Związek między działaniem farmakologicznym a budową chemiczną i konfiguracją izomerów optycznych efedryny i związków pokrewnych”. J. Pharmacol. Do potęgi. Ter. 36 363-400.
- ^ ab AM Lands (1952). „Działania sercowo-naczyniowe 1-(3-aminofenylo) -2-aminoetanolu i związków pokrewnych”. J. Pharmacol. Do potęgi. Ter. 104 474-477.
- ^ a b AM Lands i JI Grant (1952). „Działanie wazopresyjne i toksyczność pochodnych cykloheksyloetyloaminy”. J. Pharmacol. Do potęgi. Ter. 106 341-345.
- ^ a b HE Shannon, EJ Cone i D. Yousefnejad (1981). „Efekty fizjologiczne i kinetyka osocza fenyloetanoloaminy i jej N-metylowego homologu u psa”. J. Pharmacol. Do potęgi. Ter. 217 379-385.
- ^ a b G. Liapakis, WC Chan, M. Papadokostaki i JA Javitch (2004). „Synergistyczny udział grup funkcyjnych epinefryny w jej powinowactwie i skuteczności wobec receptora adrenergicznego β2 ” . Mol. Farmakol. 65 1181-1190.
- ^ Uważany za antagonistę receptorów β1 i β2 oraz agonistę receptorów β3 .
- ^ J. Axelrod (1962). „Oczyszczanie i właściwości fenyloetanoloamino-N-metylotransferazy”. J. Biol. chemia 237 1657-1660.
- ^ S. Osamu, O. Masakazu i K. Yoshinao (1980). „Charakterystyka N-metylofenyloetyloaminy i N-metylofenyloetanoloaminy jako substratów dla oksydazy monoaminowej typu A i typu B”. Biochem. Farmakol. 29 2663-2667.