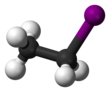
Jodek etylu

|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
jodoetan |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 505934 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.000.758 | ||
| Numer WE |
|
||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 2 H 5 I | |||
| Masa cząsteczkowa | 155,966 g·mol -1 | ||
| Wygląd | Bezbarwna ciecz | ||
| Gęstość | 1,940 g ml -1 | ||
| Temperatura topnienia | −111,10 °C; −167,98 ° F; 162,05 K | ||
| Temperatura wrzenia | 71,5 do 73,3 °C; 160,6 do 163,8 ° F; 344,6 do 346,4 K | ||
| 4 g L -1 (przy 20 °C) | |||
| Rozpuszczalność w etanolu | Mieszalny | ||
| Rozpuszczalność w eterze dietylowym | Mieszalny | ||
| dziennik P | 2.119 | ||
| Ciśnienie pary | 17,7 kPa | ||
|
Stała prawa Henry'ego
( k H ) |
1,8 μmol Pa -1 kg -1 | ||
| -69,7· 10-6 cm3 / mol | |||
|
Współczynnik załamania światła ( n D )
|
1,513–1,514 | ||
| Lepkość | 5,925 mPa-s (przy 20 ° C) | ||
| Termochemia | |||
|
Pojemność cieplna ( C )
|
109,7 JK -1 mol -1 | ||
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−39,9–38,3 kJ mol −1 | ||
|
Standardowa entalpia spalania (Δ c H ⦵ 298 ) |
−1,4629–−1,4621 MJ mol −1 | ||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
 
|
|||
| Niebezpieczeństwo | |||
| H302 , H315 , H317 , H319 , H334 , H335 | |||
| P261 , P280 , P305+P351+P338 , P342+P311 | |||
| NFPA 704 (ognisty diament) | |||
| Punkt zapłonu | 72 ° C (162 ° F; 345 K) | ||
| Śmiertelna dawka lub stężenie (LD, LC): | |||
|
LD 50 ( mediana dawki )
|
330 gm -3 (doustnie, szczur) | ||
| Związki pokrewne | |||
|
Powiązane jodoalkany
|
|||
|
Związki pokrewne
|
|||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Jodek etylu (również jodoetan ) jest bezbarwnym , łatwopalnym związkiem chemicznym . Ma wzór chemiczny C 2 H 5 I i jest przygotowywany przez ogrzewanie etanolu z jodem i fosforem . W kontakcie z powietrzem, zwłaszcza pod wpływem światła, rozkłada się i żółknie lub czerwonawo od rozpuszczonego jodu.
Można go również wytworzyć w reakcji między kwasem jodowodorowym i etanolem przez oddestylowanie jodku etylu. Jodek etylu powinien być przechowywany w obecności sproszkowanej miedzi, aby uniknąć szybkiego rozkładu, chociaż nawet przy tej metodzie próbki nie trwają dłużej niż 1 rok.
Ponieważ jodek jest dobrą grupą opuszczającą , jodek etylu jest doskonałym środkiem etylującym. Jest również stosowany jako promotor rodnika wodorowego.
Produkcja
Jodek etylu jest otrzymywany przy użyciu fosforu czerwonego, etanolu absolutnego i jodu . Jod rozpuszcza się w etanolu, gdzie reaguje z fosforem w postaci stałej, tworząc trójjodek fosforu . Podczas tego procesu temperatura jest kontrolowana.
- 3 do 2 H 5 OH + PI 3 → 3 do 2 H 5 ja + H 3 PO 3
Surowy produkt oczyszcza się przez destylację.