Kompleksy aminokwasów metali przejściowych
Kompleksy aminokwasów metali przejściowych to duża rodzina kompleksów koordynacyjnych zawierających sprzężone zasady aminokwasów , 2-aminokarboksylany. Aminokwasy występują powszechnie w przyrodzie i wszystkie działają jako ligandy w stosunku do metali przejściowych. Artykuł nie obejmuje kompleksów amidów (w tym peptydów) i estrowych pochodnych aminokwasów. Wykluczone są również poliaminokwasy, w tym środki chelatujące EDTA i NTA .
Tryby wiązania
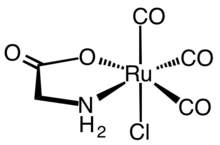
Najczęściej aminokwasy koordynują jony metali jako dwukleszczowe ligandy N, O, wykorzystując grupę aminową i karboksylan. Są to ligandy „LX”. Powstaje pięcioczłonowy pierścień chelatowy. Pierścień chelatowy jest tylko nieznacznie pofałdowany w centrach węgla i azotu zhybrydyzowanych sp 3 .
W przypadku tych aminokwasów zawierających koordynujące podstawniki, powstałe kompleksy są bardziej zróżnicowane strukturalnie, ponieważ te podstawniki mogą koordynować. Histydyna , kwas asparaginowy , metionina i cysteina czasami tworzą odpowiednio trójkleszczowe kompleksy N,N,O, N,O,O, S,N,O i S,N,O.
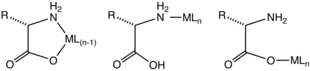
Za pomocą kinetycznie obojętnych jonów metali scharakteryzowano kompleksy zawierające aminokwasy jednokleszczowe. Kompleksy te występują w izomerach z wiązaniem N lub O. Można przypuszczać, że takie jednokleszczowe kompleksy występują przejściowo dla wielu kinetycznie labilnych jonów metali (np. Zn 2+ ).
Stechiometria i struktura
Kompleksy homoleptyczne (tylko ligandy aminokwasowe)
Mieszanie prostych soli metali z roztworami aminokwasów o pH zbliżonym do obojętnego lub o podwyższonym pH często daje kompleksy bis- lub tris. W przypadku jonów metali, które preferują koordynację oktaedryczną, kompleksy te często przyjmują stechiometrię M(aa) 3 (aa = aminokarboksylan, taki jak glicynian, H 2 NCH 2 CO 2 − ).
Kompleksy o stechiometrii 3:1 mają wzór [M(O 2 CC(R)HNH 2 ) 3 ] z . Takie kompleksy przyjmują ośmiościenną geometrię koordynacyjną . Kompleksy te mogą istnieć w izomerach twarzowych i południkowych, z których oba są chiralne. Możliwości stereochemiczne rosną, gdy ligandy aminokwasowe nie są homochiralne .
Kompleksy o stechiometrii 2:1 ilustruje glicynian miedzi(II) [Cu(O 2 CC(R)HNH 2 ) 2 ], który występuje zarówno w geometrii bezwodnej, jak i pentakoordynacyjnej. Kiedy metal jest kwadratowy, kompleksy te mogą istnieć jako izomery cis i trans. Możliwości stereochemiczne rosną, gdy ligandy aminokwasowe nie są homochiralne . Znane są również kompleksy homoleptyczne, w których aminokarboksylanem są aminokwasy trójkleszczowe. Jednym z takich kompleksów jest Ni(κ 3 -histydynian) 2 .
Peptydy i białka
Oprócz aminokwasów, peptydy i białka wiążą kofaktory metali poprzez swoje łańcuchy boczne. W większości grupy α-aminowe i karboksylanowe są niedostępne do wiązania, ponieważ w przeciwnym razie są zaangażowane w wiązanie peptydowe. Sytuacja jest bardziej skomplikowana w przypadku reszt N-końcowych i O-końcowych, gdzie odpowiednio grupy α-aminowe i karboksylanowe są niedostępne. Szczególnie ważne pod tym względem są histydyna ( imidazol ), cysteina ( tiolan ), metionina ( tioeter ).
Kompleksy heteroleptyczne (aminokwasy plus inne ligandy)
Mieszane kompleksy ligandów są wspólne dla aminokwasów. Dobrze znane przykłady obejmują [Co(en) 2 (glicynian)] 2+ , gdzie en ( etylenodiamina ) jest ligandem obserwatora. W obszarze kompleksów metaloorganicznych jeden przykład Cp*Ir(κ 3 -metionina).
Synteza i reakcje
Dobrze zbadanym kompleksem jest tris(glicinato)kobalt(III) . Podobnie jak kilka oktaedrycznych kompleksów tris (aminokarboksylanowych), jest izolowany z mieszaniny izomerów twarzowych i południkowych. Powstaje w reakcji glicyny z tris(węglano)kobaltem(III) sodu .
Powszechnie kompleksy aminokwasowe są przygotowywane w reakcjach zastępowania ligandów wodnych kompleksów metali i sprzężonych zasad aminokwasów:
- [PtCl 4 ] 2- + 2 H 2 NCH(R)CO 2 − → [Pt(H 2 NCH(R)CO 2 ) 2 ] + 4 Cl −
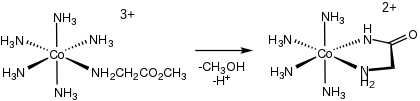
Odpowiednie dla chemii bionieorganicznej , kompleksy aminokwasów mogą być generowane przez hydrolizę estrów i amidów aminokwasów (en = etylenodiamina ):
- [(en) 2 CoOH(κ 1N -H 2 NCH(R)CO 2 Et)] 2+ → [(en) 2CoOH (κ 2NO -H 2NCH (R)CO 2 )] 2+ + EtOH
Ponieważ ich 5-członowy pierścień chelatowy MNC 2 O jest raczej stabilny, kompleksy aminokwasowe stanowią grupy zabezpieczające aminokwasy, umożliwiając różnorodne reakcje łańcuchów bocznych.
Kompleksy aminokarboksylanowe
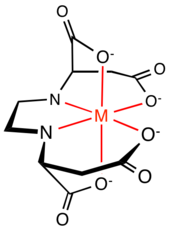
Związki organiczne zawierające dwie lub więcej grup 2- i 3-aminokarboksylanowych są ligandami szeroko stosowanymi w przyrodzie, przemyśle i badaniach. Znane przykłady obejmują EDTA i NTA .
-
Bibliografia
_ Bergs, R.; Beck, W. (1998). „Bioorganometaliczna chemia i kompleksy metali przejściowych z α-aminokwasami i peptydami”. Angew. chemia Int. wyd . 37 (12): 1635-1654. doi : 10.1002/(SICI)1521-3773(19980703)37:12<1634::AID-ANIE1634>3.0.CO;2-C . PMID 29711516 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
Bibliografia
_ Gu, Y.-X. Sun, R. Zhang, N.-W. Zhang, H.-W. Che (2007). „Tris (glicinato-κ 2 N, O) kobalt (III)”. Acta Crystallogr . E63 (3): m740 – m742. doi : 10.1107/S1600536807005636 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
^
A. Abbasi, B. Safarkoopayeh, N. Khosravi, A. Shayesteh (217). „Badania strukturalne bis (histidinato) niklu (II): połączone badania eksperymentalne i obliczeniowe” . Comptes Rendus Chimie . 20 (5): 467. doi : 10.1016/j.crci.2016.12.006 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) -
^
M. Scharwitz, T. van Almsick, WS Sheldrick (2007). "(S-metylocysteinato) (η 5 -pentametylocyklopentadienylo) iryd (III) półwodzian trifluorometanosulfonianu". Acta Crystallogr . E63 : m230-m232. doi : 10.1107/S1600536806053360 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) -
^
Baidya, N.; Ndreu, D.; Olmstead, MM; Mascharak, PK (1991). „Synteza, struktura i właściwości seskwihydratu bis (L-cysteinato-N, S) niklu (II) potasu”. Chemia nieorganiczna . 30 (10): 2448–2451. doi : 10.1021/ic00010a043 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) - ^ Motterlini R, Otterbein LE (wrzesień 2010). „Potencjał terapeutyczny tlenku węgla”. artykuł przeglądowy. Recenzje przyrody. Odkrycie leku . 9 (9): 728–43. doi : 10.1038/nrd3228 . PMID 20811383 . S2CID 205477130 .
- ^ Kauffman, George B.; Karbassi, Mahomet; Kyuno, Eishin (1989). „Tris (glicynato) kobalt (III)”. Syntezy nieorganiczne . Syntezy nieorganiczne. Tom. 25. s. 135–139. doi : 10.1002/9780470132562.ch32 . ISBN 9780470132562 .
- Bibliografia _ Hadjiliadis, N. (1994). „Złożone związki platyny (II) i (IV) z aminokwasami, peptydami i ich pochodnymi”. Recenzje chemii koordynacyjnej . 135-136: 17-63. doi : 10.1016/0010-8545(94)80064-2 .
- ^ Wolfganga Becka (2009). „Jony metali i kompleksy metali jako grupy ochronne aminokwasów i peptydów - reakcje na skoordynowanych aminokwasach” . Z. Naturforsch . 64b : 1221–1245. doi : 10.1515/znb-2009-11-1202 . S2CID 96555456 .

![Co(glycinate)3[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/SEZMEQ.png/180px-SEZMEQ.png)
![[Ni(κ3-histidinate)2]2-[3]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9b/RAGZAD.png/143px-RAGZAD.png)
![[Cp*Ir(κ3-methionine)]+[4]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/41/GEVLID.png/168px-GEVLID.png)
![[Ni(cysteinate)2]2-[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/47/KIWZOF.png/180px-KIWZOF.png)