Kompleks karboksylanów metali przejściowych

Kompleksy karboksylanowe metali przejściowych to kompleksy koordynacyjne z ligandami karboksylanowymi (RCO 2 − ) . Odzwierciedlając różnorodność kwasów karboksylowych, inwentarz karboksylanów metali jest duży. Wiele z nich jest użytecznych komercyjnie, a wiele z nich przyciągnęło intensywną analizę naukową. Karboksylany wykazują różne tryby koordynacji, najczęstsze to κ 1 - (O-jednokleszczowy), κ 2 (O, O-dwukleszczowy) i mostkowanie.
Struktura i wiązanie
Karboksylany wiążą się z pojedynczymi metalami przez jeden lub oba atomy tlenu, odpowiednio oznaczając κ 1 - i κ 2 -. Pod względem liczenia elektronów , κ 1 -karboksylany są ligandami typu „X”, tj. pseudohalogenkami. κ 2 -karboksylany są „ligandami LX”, tj. przypominają połączenie zasady Lewisa (L) i pseudohalogenku (X). Karboksylany są klasyfikowane jako twarde ligandy w HSAB .
- Struktury wybranych octanów metali
Octan molibdenu (II) , ilustrujący poczwórne wiązanie Mo-Mo.
[CoO(octan)] 4 , „ Das cubane ”
W przypadku prostych karboksylanów ilustracją są kompleksy octanowe. Większość octanów metali przejściowych to mieszane kompleksy ligandów. Typowym przykładem jest uwodniony octan niklu , Ni(O 2 CCH 3 ) 2 (H 2 O) 4 , który charakteryzuje się wewnątrzcząsteczkowymi wiązaniami wodorowymi między nieskoordynowanymi atomami tlenu i protonami wodnych ligandów . Stechiometrycznie proste kompleksy są często multimetaliczne. Jedną rodzinę stanowią zasadowe octany metali o stechiometrii [M 3 O(OAc) 6 (H 2 O) 3 ] n+ .
Kompleksy homoleptyczne
Homoleptyczne kompleksy karboksylanowe są zwykle polimerami koordynacyjnymi . Ale istnieją wyjątki.
- Cząsteczkowym monokarboksylanem jest octan srebra , Ag2 ( OAc) 2 .
- Dioctany molekularne są bardziej powszechne. Kilka dioctanów przyjmuje strukturę chińskiej latarni . Dobrze zbadane przykłady obejmują tetraoctany dimetalu (M2 ( OAc) 4 ), w tym octan rodu(II) , octan miedzi(II) , octan molibdenu(II) i octan chromu(II) . Dioctan platyny i dioctan palladu zawierają Pt 4 i Pd 3 rdzenie, co dodatkowo ilustruje tendencję ligandów octanowych do stabilizowania struktur wielometalicznych.
- Trioctany jednojądrzaste obejmują pochodne kwasu 1-adamantanokarboksylowego , które mają wzór [M(O 2 CC 10 H 11 ) 4 ] - (M = Co, Ni, Zn).
Reakcje i aplikacje
Próby przygotowania niektórych kompleksów karboksylanowych, zwłaszcza dla metali elektrofilowych, często dają pochodne okso. Przykłady obejmują oksooctany Fe(III), Mn(III) i Cr(III).
Octany metali są powszechnymi katalizatorami lub prekatalizatorami. Szczególnie przydatne są etyloheksaniany i pokrewne mydła metaliczne. Te lipofilowe kompleksy są stosowane jako katalizatory w reakcjach utleniania, np. jako środki osuszające olej .
Synteza
Wiele metod pozwala na syntezę karboksylanów metali. Z wstępnie uformowanego kwasu karboksylowego wykazano następujące drogi:
- reakcje kwasowo-zasadowe: L n MOR' + RCO 2 H → L n MO 2 CR + R'OH
- protonoliza: L n Malkil + RCO 2 H → L n MO 2 CR + alkan
- addycja utleniająca : L n M + RCO 2 H → L n (H) MO 2 CR
Ze wstępnie uformowanego karboksylanu często występują reakcje metatezy soli :
- L n MCl + RCO 2 Na → L n MO 2 CR + NaCl
Karboksylany metali można wytworzyć przez karbonatyzację alkili metali o wysokiej zawartości:
- L n MR + CO 2 → L n MO 2 CR
Reakcje
Powszechną reakcją karboksylanów metali jest ich wypieranie przez bardziej zasadowe ligandy. Octan jest powszechną grupą opuszczającą . Są szczególnie podatne na protonolizę, która jest szeroko stosowana do wprowadzania ligandów, wypierających kwas karboksylowy. W ten sposób oktachlorodimolibdenian jest wytwarzany z tetraoctanu dimolibdenu :
- Mo 2 (O 2 CCH 3 ) 4 + 8 HCl → [Mo 2 Cl 8 ] 2 − + 4 CH 3 CO 2 H
Proponuje się, aby octany metali elektrofilowych działały jako zasady w skoordynowanych reakcjach deprotonowania metalacji .
Piroliza karboksylanów metali daje bezwodniki kwasowe i tlenek metalu. Ta reakcja wyjaśnia powstawanie zasadowego octanu cynku z bezwodnego dioctanu cynku .
W niektórych przypadkach jednokleszczowe karboksylany ulegają O-alkilowaniu z wytworzeniem estrów. Wymagane są silne środki alkilujące.
Di- i polikarboksylany
Benzenodi- i trikarboksylany
Ramy metaloorganiczne , porowate, trójwymiarowe polimery koordynacyjne, często pochodzą z klastrów karboksylanów metali. Te klastry, zwane drugorzędowymi jednostkami wiążącymi (SBU), są często połączone sprzężonymi zasadami kwasów benzenodi- i trikarboksylowych.
Aminopolikarboksylany
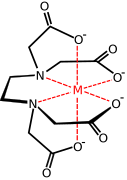
kompleks metalu z anionem EDTA
Ważna z handlowego punktu widzenia rodzina karboksylanów metali pochodzi od aminopolikarboksylanów , np. EDTA 4- . Z tymi syntetycznymi czynnikami chelatującymi spokrewnione są aminokwasy , które tworzą duże rodziny kompleksów aminokwasowych . Dwa aminokwasy, glutaminian i asparaginian, mają karboksylanowe łańcuchy boczne, które działają jako ligandy żelaza w niehemowych białkach żelaza, takich jak hemerytryna .
- ^ Brignole, Alicja B.; Bawełna, FA (1972). „Związki renu i molibdenu zawierające poczwórne wiązania”. Syntezy nieorganiczne . 13 : 81–89. doi : 10.1002/9780470132449.ch15 .
- Bibliografia _ Thornton, Peter (1977). Struktury i właściwości fizyczne wielopierścieniowych karboksylanów . Postępy w chemii nieorganicznej i radiochemii . Tom. 20. s. 291–362. doi : 10.1016/S0065-2792(08)60041-2 . ISBN 9780120236206 .
- Bibliografia _ Lin, Jian; Guo, Dong-Wei; Yao, Shi-Yan; Tian, Yun-Qi (2010). „Nieskończone polimery koordynacyjne jedno- i dwuwymiarowych octanów kobaltu”. Zeitschrift für Anorganische und Allgemeine Chemie . 636 (7): 1401-1404. doi : 10.1002/zaac.200900457 .
- ^ Fursowa, E. Yu .; Romanenko, GV; Tolstikov, SE; Owczarenko, VI (2019). „Jednojądrowe metale przejściowe Adamantano-1-karboksylany”. Rosyjski Biuletyn Chemiczny . 68 (9): 1669-1674. doi : 10.1007/s11172-019-2610-4 . S2CID 203592748 .
- ^ Nora, Angelo; Szczepanek Alfred; Koenen, Gunther (2001). „Mydła metaliczne”. Encyklopedia chemii przemysłowej Ullmanna . doi : 10.1002/14356007.a16_361 . ISBN 3527306730 .
- ^ García-Rodríguez, Raúl; Hendricks, Mark P.; Cossairt, Brandi M.; Liu, Haitao; Owen, Jonathan S. (2013). „Reakcje konwersji prekursorów nanokryształów chalkogenku kadmu”. Chemia materiałów . 25 (8): 1233–1249. doi : 10,1021/cm3035642 .
- ^ Ackermann, Lutz (2011-03-09). „Funkcjonalizacje wiązań C-H wspomagane karboksylanem, katalizowane metalem przejściowym: mechanizm i zakres” . Recenzje chemiczne . 111 (3): 1315–1345. doi : 10.1021/cr100412j . ISSN 0009-2665 . PMID 21391562 .
- ^ Tranchemontagne, David J.; Mendoza-Cortés, José L.; o'Keeffe, Michael; Yaghi, Omar M. (2009). „Drugorzędne jednostki budulcowe, sieci i wiązania w chemii struktur metaloorganicznych” . Recenzje Towarzystwa Chemicznego . 38 (5): 1257. doi : 10.1039/b817735j . PMID 19384437 .
- ^ Jaśniewski, Andrzej J.; Que, Lawrence (2018). „Aktywacja ditlenowa przez niehemowe enzymy diironowe: różne addukty ditlenowe, półprodukty o wysokiej wartościowości i pokrewne kompleksy modelowe” . Recenzje chemiczne . 118 (5): 2554–2592. doi : 10.1021/acs.chemrev.7b00457 . PMC 5920527 . PMID 29400961 .
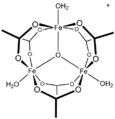


![[CoO(acetate)]4, the "Das cubane"](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/DasCubane.svg/120px-DasCubane.svg.png)