Acetyloacetoniany metali
Acetyloacetoniany metali to kompleksy koordynacyjne pochodzące z anionu acetyloacetonianowego ( CH
3 COCHCOCH
− 3 ) i jonów metali, zwykle metali przejściowych . Dwukleszczowy ligand acetyloacetonianowy jest często określany skrótem acac. Zazwyczaj oba atomy tlenu wiążą się z metalem, tworząc sześcioczłonowy pierścień chelatowy. Najprostsze kompleksy mają wzór M(acac) 3 i M(acac) 2 . Mieszane kompleksy ligandów, np. VO(acac) 2 , są również liczne. Opracowano również odmiany acetyloacetonianu z niezliczonymi podstawnikami zamiast metylu (RCOCHCOR ′ - ). Wiele takich kompleksów jest rozpuszczalnych w rozpuszczalnikach organicznych , w przeciwieństwie do pokrewnych halogenków metali. Ze względu na te właściwości kompleksy acac są czasami stosowane jako katalizatorów i odczynniki. Zastosowania obejmują ich zastosowanie jako NMR i katalizatorów do syntezy organicznej oraz prekursorów przemysłowych katalizatorów hydroformylowania . C5H
_ _
7 O
- 2 w niektórych przypadkach wiąże się również z metalami przez centralny atom węgla; ten tryb wiązania jest bardziej powszechny w przypadku metali przejściowych trzeciego rzędu, takich jak platyna (II) i iryd (III).
Synteza
Zwykła synteza obejmuje traktowanie soli metalu acetyloacetonem, acacH:
- M z + + z Hacac ⇌ M (acac) z + z H +
Dodatek zasady pomaga usunąć proton z acetyloacetonu i przesuwa równowagę na korzyść kompleksu. Oba centra tlenu wiążą się z metalem, tworząc sześcioczłonowy pierścień chelatowy. W niektórych przypadkach efekt chelatowania jest tak silny, że do utworzenia kompleksu nie jest potrzebna żadna dodatkowa zasada. Niektóre kompleksy wytwarza się przez metatezę z użyciem T1 (acac).
Struktura i wiązanie
W większości swoich kompleksów acac tworzy sześcioczłonowe pierścienie chelatowe C 3 O 2 M. Pierścień M (acac) jest płaski z płaszczyzną symetrii przecinającą pierścień na pół.
Pierścień acacM generalnie wykazuje charakter aromatyczny, co odpowiada zdelokalizowanemu wiązaniu w monoanionowej części C3O2 . Zgodnie z tym scenariuszem, w niektórych kompleksach ligand acac jest podatny na podstawienie elektrofilowe, podobne do elektrofilowego podstawienia aromatycznego (w tym równaniu Me = CH 3 ):
- Co(O 2 C 3 Me 2 H) 3 + 3 NO 2 + → Co (O 2 C 3 Me 2 NO 2 ) 3 + 3 H +
Pod względem liczenia elektronów neutralny dwukleszczowy ligand acac związany z wiązaniami O,O jest „ligandem LX”, tj. kombinacją zasady Lewisa (L) i pseudohalogenku (X).
Wyjątkiem od powyższego klasycznego opisu jest addukt bis(pirydyny) z acetyloacetonianem chromu(II), który zawiera niewinny 2- ligand acac .
Klasyfikacja według triady
Triada tytanowa
Traktowanie TiCl 4 acetyloacetonem daje TiCl 2 (acac) 2 , czerwono zabarwiony ośmiościenny kompleks o symetrii C 2 :
- TiCl4 + 2 Hacac → TiCl2 ( acac) 2 + 2 HCl
Ta reakcja nie wymaga zasady. Kompleks TiCl 2 (acac) 2 jest topnikiem w roztworze, widmo NMR wykazuje pojedynczy rezonans metylowy w temperaturze pokojowej.
W przeciwieństwie do Ti (IV), zarówno Zr (IV), jak i Hf (IV) wiążą cztery dwukleszczowe acetyloacetoniany, odzwierciedlając większy promień tych metali. Acetyloacetonian hafnu i acetyloacetonian cyrkonu przyjmują kwadratowe struktury antypryzmatyczne.
Jeśli chodzi o acetyloacetoniany tytanu (III), Ti (acac) 3 jest dobrze zbadany. Ten niebieski związek powstaje z trichlorku tytanu i acetyloacetonu.
triada wanadu

Acetyloacetonian wanadylu jest niebieskim kompleksem o wzorze V(O)(acac) 2 . Ten kompleks zawiera wanadylu (IV) i znanych jest wiele powiązanych związków. Cząsteczka ma kształt piramidy kwadratowej, z wyidealizowaną C2v . Kompleks katalizuje epoksydację alkoholi allilowych przez nadtlenki. Acetyloacetonian wanadu(III). jest ciemnobrązową substancją stałą. Kompleksy β-diketonianu wanadu są stosowane jako prekatalizatory w komercyjnej produkcji elastomerów etylenowo-propylenowo-dienowych (EPDM). Często są oceniane pod kątem innych zastosowań związanych z bateriami przepływowymi redoks, cukrzycą i zwiększaniem aktywności insuliny oraz jako prekursory materiałów nieorganicznych przez CVD.
Triada chromu
Acetyloacetonian chromu(III) , Cr(acac) 3 , jest typowym oktaedrycznym kompleksem zawierającym trzy ligandy acac − . Podobnie jak większość takich związków, jest dobrze rozpuszczalny w niepolarnych rozpuszczalnikach organicznych. Ten konkretny kompleks, który ma trzy niesparowane elektrony, jest używany jako środek relaksacji spinu w celu poprawy czułości w ilościowej węgla-13 NMR . Acetyloacetonian chromu (II) jest wysoce wrażliwym na tlen, jasnobrązowym związkiem. Kompleks przyjmuje kwadratową płaską strukturę , słabo związane w stosy w stanie stałym. Jest izomorficzny z Pd(acac) 2 i Cu(acac) 2 .
Triada manganu
Otrzymano go przez komproporcjonowanie związku manganu(II) Mn(acac) 2 z nadmanganianem potasu w obecności dodatkowej ilości acetyloacetonu. Alternatywnie bezpośrednia reakcja acetyloacetonu z nadmanganianem potasu . Pod względem struktury elektronowej Mn(acac) 3 ma wysoki spin . Jego zniekształcona ośmiościenna struktura odzwierciedla zniekształcenia geometryczne spowodowane efektem Jahna-Tellera . Dwie najczęstsze struktury tego kompleksu to jedna z tetragonalnym wydłużeniem i jedna z tetragonalną kompresją. W przypadku wydłużenia dwa wiązania Mn – O mają 2,12 Å, podczas gdy pozostałe cztery to 1,93 Å. W przypadku kompresji dwa wiązania Mn – O mają 1,95 Å, a pozostałe cztery to 2,00 Å. Efekty wydłużenia tetragonalnego są zauważalnie bardziej znaczące niż efekty kompresji tetragonalnej.
W chemii organicznej Mn(acac) 3 był używany jako jednoelektronowy utleniacz do sprzęgania fenoli.
Żelazna triada
Acetyloacetonian żelaza(III) , Fe(acac) 3 , jest czerwonym kompleksem o wysokim spinie , który jest dobrze rozpuszczalny w rozpuszczalnikach organicznych. Jest to kompleks o wysokim spinie z pięcioma niesparowanymi elektronami. Od czasu do czasu badano go jako prekursor katalizatora. Fe (acac) 3 został częściowo rozdzielony na izomery Δ i Λ . Kompleks żelazawy Fe(acac) 2 jest oligomerem.
Podobnie jak żelazo, Ru(III) tworzy stabilny tris(acetyloacetonian) . Redukcja tej pochodnej Ru(III) w obecności innych ligandów daje mieszane kompleksy ligandów, np. Ru(acac) 2 (alken) 2 .
Triada kobaltowa

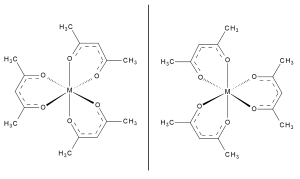
Tris(acetyloacetoniano)kobalt(III) , Co(acac) 3 , jest niskospinowym, diamagnetycznym kompleksem. Podobnie jak inne związki typu M(acac) 3 , kompleks ten jest chiralny (posiada nienakładające się lustrzane odbicie).
Synteza Co(acac) 3 wymaga użycia utleniacza, ponieważ prekursory kobaltu są dwuwartościowe:
- 2 CoCO 3 + 6 Hacac + H 2 O 2 → 2 Co(acac) 3 + 4 H 2 O + 2 CO 2
Kompleks „Co(acac) 2 ”, podobnie jak kompleks niklu o analogicznej stechiometrii, jest zazwyczaj izolowany dwoma dodatkowymi ligandami, tj. oktaedrycznym Co(acac) 2 L 2 . Postać bezwodna występuje jako tetramer [Co(acac) 2 ] 4 . Podobnie jak trimeryczny kompleks niklu, ten tetramer wykazuje oddziaływania ferromagnetyczne w niskich temperaturach.
Ir(acac) 3 i Rh(acac) 3 są znane. Znany jest drugi izomer wiązania kompleksu irydu, trans -Ir(acac) 2 ( CH (COMe) 2 )(H2O ) . Ta C jest prekursorem jednorodnych katalizatorów do aktywacji C – H i powiązanych chemii.
Dwa dobrze zbadane acetyloacetoniany rodu(I) i irydu(I) to Rh(acac)(CO) 2 i Ir(acac)(CO) 2 . Te kompleksy są kwadratowo-płaskie, z C2v .
Triada niklowa
Bis(acetyloacetonian) niklu(II) występuje jako trimetaliczny kompleks [Ni(acac) 2 ] 3 . Masywne beta-diketoniany dają czerwone, monomeryczne, kwadratowo-płaskie kompleksy. Bis(acetyloacetonian) niklu(II) reaguje z wodą, dając ośmiościenny addukt [Ni(acac) 2 (H 2 O) 2 ] , kredowozielone ciało stałe.
W przeciwieństwie do skomplikowanego magnetyzmu i struktury Ni(acac) 2 , bis(acetyloacetonian) platyny(II) i bis(acetyloacetonian) palladu(II) są diamagnetycznymi monometalami.
Miedziana triada
Cu(acac) 2 wytwarza się przez traktowanie acetyloacetonu wodnym roztworem Cu(NH3
) 2
+ 4 . Jest dostępny w handlu, katalizuje reakcje sprzęgania i przenoszenia karbenu.
W przeciwieństwie do pochodnej miedzi (II), acetyloacetonian miedzi (I) jest wrażliwą na powietrze formą oligomeryczną. Jest stosowany do katalizowania addycji Michaela .
Triada cynku
Monoaquo kompleks Zn(acac) 2 H 2 O ( temperatura topnienia 138-140 °C) ma pięciowspółrzędną, przyjmującą kwadratową piramidalną strukturę. Kompleks ma pewne zastosowanie w syntezie organicznej . Odwodnienie tego gatunku daje higroskopijną bezwodną pochodną (temperatura topnienia 127 °C). Ta bardziej lotna pochodna została wykorzystana jako prekursor filmów ZnO .
Acetyloacetoniany innych pierwiastków
Bezbarwny, diamagnetyczny Al (acac) 3 jest strukturalnie podobny do innych kompleksów tris, np. [Fe(acac) 3 ]. Trisacetyloacetoniany lantanowców często przyjmują liczby koordynacyjne powyżej 8.
Warianty ak
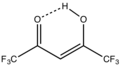
Wiele wariantów acetyloacetonianów jest dobrze rozwiniętych. Heksafluoroacetyloacetoniany i trifluoroacetyloacetoniany tworzą kompleksy, które często są strukturalnie podobne do zwykłych acetyloacetonianów, ale są bardziej kwaśne Lewisa i bardziej lotne. Kompleks Eufod , Eu (OCC(CH 3 ) 3 CHCOC 3 F 7 ) 3 zawiera rozbudowany częściowo fluorowany ligand. Kompleks ten jest kwasem Lewisa, tworzącym addukty z różnymi twardymi zasadami.
Jedno lub oba centra tlenu w acetyloacetonianie można zastąpić grupami RN, dając początek ligandom Nacac i Nacnac .
Tautomery i kompleksowanie Nacnac
„Odczynnik do przesunięcia NMR” Eufod
Tetraacetyletan , który tworzy kompleksy bimetaliczne
2,4,6-heptanetrion , dwujądrowy ligand.
Acetyloacetoniany związane z wiązaniem C
C
5 H
7 O
− 2 w niektórych przypadkach wiąże się również z metalami poprzez centralny atom węgla (C3); ten tryb wiązania jest bardziej powszechny w przypadku metali przejściowych trzeciego rzędu, takich jak platyna (II) i iryd (III). Kompleksy Ir(acac) 3 i odpowiadające im addukty zasady Lewisa Ir(acac) 3 L (L = an amina ) zawierają jeden związany z węglem ligand acac. Widma IR O charakteryzują się stosunkowo niskoenergetycznymi pasmami ν CO o długości 1535 cm -1 , podczas gdy w acetyloacetonianach związanych z węglem drgania karbonylowe występują bliżej normalnego zakresu dla ketonowego C=O, tj. 1655 cm −1 .





![Tetraacetylethane, which forms bimetallic complexes[28]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4e/Ac4C2H2.svg/81px-Ac4C2H2.svg.png)
![Triacetylmethane[29]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/31/Ac3CH.svg/120px-Ac3CH.svg.png)