Tris(acetyloacetoniano)kobalt(III)
|
|
| Nazwy | |
|---|---|
| Inne nazwy Acetyloacetonian kobaltu(III), kobalt tris(acac).
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.040.464 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C15H21CoO6 _ _ _ _ _ _ | |
| Masa cząsteczkowa | 356,260 g·mol -1 |
| Wygląd | zielone ciało stałe |
| Gęstość | 1,41 g/ cm3 |
| Temperatura topnienia | 213 ° C (415 ° F; 486 K) |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H302 , H317 , H334 | |
| P261 , P264 , P270 , P272 , P280 , P285 , P301+P312 , P302+P352 , P304+P341 , P321 , P330 , P333+P313 , P342+P311 , P363 , P501 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
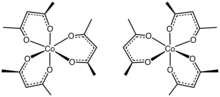
Tris(acetyloacetoniano)kobalt(III) jest kompleksem koordynacyjnym o wzorze Co(C 5 H 7 O 2 ) 3 . Często w skrócie Co(acac) 3 , jest to zielone, diamagnetyczne ciało stałe, które jest rozpuszczalne w rozpuszczalnikach organicznych, ale nie w wodzie. Dzięki rozpuszczalności w rozpuszczalnikach organicznych tris(acetyloacetoniano)kobalt(III) jest wykorzystywany do produkcji katalizatorów homogenicznych metodą redukcji.
Struktura
Strukturę kompleksu potwierdzono metodą krystalografii rentgenowskiej . Trzy ligandy acac . wiążą się z kobaltem w sposób dwukleszczowy, tworząc oktaedryczny kompleks Ciało stałe jest izomorficzne z tris (acetyloacetonato) żelazem (III) , tris (acetyloacetoniano) manganem (III) i tris (acetyloacetoniano) glinem. Przy symetrii D3 kompleksy te są chiralne i często można je rozdzielić na pojedyncze enancjomery.
Synteza i reakcje
Tris(acetyloacetoniano)kobalt(III) otrzymuje się w reakcji węglanu kobaltu(II) i acetyloacetonu w obecności nadtlenku wodoru :
- 2 CoCO 3 + 6 CH 3 COCH 2 COCH 3 + H 2 O 2 → 2 Co(O 2 C 3 Me 2 H) 3 + 2 CO 2 + 4 H 2 O
Charakterystycznym aspektem Co(acac) 3 jest jego podatność na elektrofilową substytucję aromatyczną , w wyniku której protony na centralnym atomie węgla są zastępowane różnymi elektrofilami (Me = metyl ):
- Co(O 2 C 3 Me 2 H) 3 + 3 NO 2 + → Co (O 2 C 3 Me 2 NO 2 ) 3 + 3 H +
- ^ Mayo, Peter D.; Tam, William (2002). „Tris (acetoacetonylo) kobalt”. Encyklopedia odczynników do syntezy organicznej . doi : 10.1002/047084289X.rn00084 . ISBN 0471936235 .
- ^ Arslan, Evrim; Lalancette, Roger A.; Bernal, Iwan (2017). „Historyczne i naukowe badanie właściwości tris-acetyloacetonianów metali (III)”. Chemia strukturalna . 28 : 201–212. doi : 10.1007/s11224-016-0864-0 . S2CID 99668641 .
- Bibliografia _ Ferneliusz, W. Conard (1957). „Acetyloacetonian kobaltu (III)” . Syntezy nieorganiczne . 5 : 188-189. doi : 10.1002/9780470132364.ch53 . ISBN 9780470132364 .
- ^ Shalhoub, George M. (1980). „Co (acac) 3 Synteza, reakcje i widma: eksperyment z chemii ogólnej”. Journal of Chemical Education . 57 (7): 525. Bibcode : 1980JChEd..57..525S . doi : 10.1021/ed057p525 .