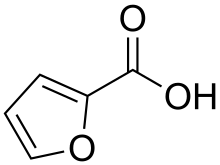
Kwas 2-furoesowy
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Kwas furano-2-karboksylowy |
|
Inne nazwy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 110149 | |
| CHEBI | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.001.639 |
| 3056 | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C5H4O3 _ _ _ _ _ | |
| Masa cząsteczkowa | 112,084 g·mol -1 |
| Wygląd | Biały / białawy (beżowy) krystaliczny proszek |
| Gęstość | 0,55 g/cm 3 |
| Temperatura topnienia | 128 do 132 ° C (262 do 270 ° F; 401 do 405 K) |
| Temperatura wrzenia | 230 do 232 ° C (446 do 450 ° F; 503 do 505 K) |
| Łatwo rozpuszczalny w zimnej i gorącej wodzie, 27,1 g/L | |
| Kwasowość ( p Ka ) | 3,12 w 25°C |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Działa drażniąco na oczy, drogi oddechowe i skórę. |
| Oznakowanie GHS : | |

|
|
| Ostrzeżenie | |
| H315 , H319 , H335 | |
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332 + P313 , P337 + P313 , P362 , P403+P233 , P405 , P50 1 | |
| NFPA 704 (ognisty diament) | |
| Związki pokrewne | |
|
Związki pokrewne
|
Kwas 2-tiofenokarboksylowy, Kwas 3-furoinowy, Alkohol furfurylowy, Kwas 2,5-furandikarboksylowy, Furfurylamina |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Kwas 2-furoesowy jest związkiem organicznym , składającym się z pierścienia furanowego i grupy bocznej kwasu karboksylowego . Wraz z innymi furanami, jego nazwa pochodzi od łacińskiego słowa furfur , oznaczającego otręby, z których po raz pierwszy wytworzono te związki. Sole i estry kwasów furoinowych są znane jako furaniany . Kwas 2-furoesowy jest najczęściej spotykany w produktach spożywczych jako środek konserwujący i aromatyzujący, gdzie nadaje słodki, ziemisty smak.
Historia
Związek ten został po raz pierwszy opisany przez Carla Wilhelma Scheele w 1780 roku, który otrzymał go przez suchą destylację kwasu śluzowego . Z tego powodu był początkowo znany jako kwas piromucynowy. Była to pierwsza znana synteza furanu , druga to furfural w 1821 r. Mimo to to furfural ustalił konwencje nazewnictwa dla późniejszych furanów.
Przygotowanie i synteza

Kwas 2-furoesowy można zsyntetyzować przez utlenienie alkoholu furfurylowego lub furfuralu . Można to osiągnąć chemicznie lub biokatalitycznie .
Obecna droga przemysłowa obejmuje reakcję Cannizaro furfuralu w wodnym roztworze NaOH. Jest to dysproporcjonowania i daje stosunek 1: 1 kwasu 2-furoesowego i alkoholu furfurylowego (50% wydajności każdego). Pozostaje ekonomiczny, ponieważ oba produkty mają wartość handlową. Droga biokatalityczna obejmuje mikroorganizm Nocardia corallina . Daje to kwas 2-furoinowy z wyższą wydajnością: 98% z alkoholu 2-furfurylowego i 88% z 2-furfuralu, ale nie został jeszcze wprowadzony na rynek.
Zastosowania i zdarzenia

Jeśli chodzi o zastosowania komercyjne, kwas 2-furoesowy jest często używany do produkcji estrów furoinianowych, z których niektóre są lekami i pestycydami.
w produktach spożywczych
Jest to składnik aromatyzujący i uzyskał ogólnie uznany status bezpieczny (GRAS) w 1995 roku przez Stowarzyszenie Producentów Aromatów i Ekstraktów (FEMA). Kwas 2-furoesowy ma wyraźny zapach opisywany jako słodki, oleisty, zielny i ziemisty.
Kwas 2-furoinowy pomaga sterylizować i pasteryzować wiele produktów spożywczych. Tworzy się in situ z 2-furfuralu. Kwas 2-furoinowy powstaje również podczas palenia kawy w ilości do 205 mg/kg.
Właściwości optyczne
Kryształy kwasu 2-furoesowego są wysoce przezroczyste w zakresie długości fal 200–2000 nm, są stabilne do 130 ° C i generalnie mają niską absorpcję w zakresie UV , widzialnym i podczerwonym . W badaniach optycznych i dielektrycznych kryształy kwasu 2-furoinowego mogą działać jako paraelektryki w zakresie temperatur < 318 K i ferroelektryki w zakresie temperatur > 318 K.
Metabolizm drobnoustrojów
Kwas 2-furoesowy może być jedynym źródłem węgla i energii dla organizmu Pseudomonas putida . Organizm rozkłada tlenowo związek.
Zagrożenia
LD50 wynosi 100 mg/kg (doustnie, szczury).
Dalsza lektura
- Greenwood, Norman N .; Earnshaw, Alan (1997). Chemia pierwiastków (wyd. 2). Butterwortha-Heinemanna . ISBN 978-0-08-037941-8 .
- „Kwas 2-furoesowy [Karta charakterystyki materiału]” . Sciencelab.com . 9 października 2005 r. Zarchiwizowane od oryginału w dniu 17 października 2012 r . Źródło 15 marca 2013 r .
