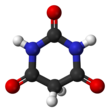
Kwas barbiturowy
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
1,3-diazynano-2,4,6-trion |
|||
Inne nazwy
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 3DMet | |||
| 120502 | |||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.000.598 | ||
| Numer WE |
|
||
| 101571 | |||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C4H4N2O3 _ _ _ _ _ _ _ | |||
| Masa cząsteczkowa | 128,087 g · mol -1 | ||
| Wygląd | Białe kryształy | ||
| Temperatura topnienia | 245 ° C (473 ° F; 518 K) | ||
| Temperatura wrzenia | 260 ° C (500 ° F; 533 K) | ||
| 142 g/l (20°C) | |||
| Kwasowość ( p Ka ) | 4,01 ( H2O ) | ||
|
|||
| Zagrożenia | |||
| Oznakowanie GHS : | |||

|
|||
| Ostrzeżenie | |||
| H315 , H319 , H335 | |||
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332 + P313 , P337 + P313 , P362 , P403+P233 , P405 , P50 1 | |||
| NFPA 704 (ognisty diament) | |||
| Karta charakterystyki (SDS) | Zewnętrzna karta charakterystyki | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Kwas barbiturowy lub malonylomocznik lub 6-hydroksyuracyl jest związkiem organicznym opartym na heterocyklicznym szkielecie pirymidynowym . Jest to bezwonny proszek rozpuszczalny w wodzie. Kwas barbiturowy jest związkiem macierzystym barbituranowych , chociaż sam kwas barbiturowy nie jest aktywny farmakologicznie. Związek został po raz pierwszy zsyntetyzowany przez Adolfa von Baeyera .
Nazewnictwo
Nie jest jasne, dlaczego Baeyer nazwał związek, który odkrył, „kwasem barbiturowym”. W swoim podręczniku Chemii organicznej amerykański chemik organiczny Louis Frederick Fieser (1899–1977) początkowo spekulował, że nazwa pochodzi od niemieckiego słowa Schlüsselbart ( dosłownie broda ( łac . kawałek klucza), ponieważ Baeyer uważał kwas barbiturowy za główny (lub „klucz”) do zrozumienia kwasu moczowego i jego pochodnych. Jednak później Fieser zdecydował, że Baeyer nazwał związek na cześć młodej kobiety, którą spotkał i która nazywała się „Barbara”, stąd nazwa „kwas barbiturowy” była połączeniem imienia „Barbara” i „kwas moczowy”. Inne źródła podają, że Baeyer nazwał kompleks imieniem św. Barbary , albo dlatego, że odkrył go w święto św. Barbary (4 grudnia), albo dlatego, że czasami jadał obiady z oficerami artylerii, a św. Barbara jest ich patronką.
Synteza
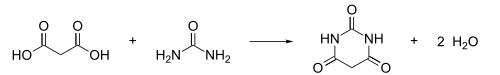
Kwas barbiturowy został po raz pierwszy otrzymany i nazwany w 1864 roku przez niemieckiego chemika Adolfa von Baeyera poprzez redukcję tego, co Baeyer nazwał bromkiem alloksanu ( dibromek alloksanu , obecnie: kwas 5,5-dibromobarbiturowy) kwasem cyjanowodorowym , a później przez redukcję kwasu dibromobarbiturowego kombinacją amalgamat sodu i jodowodór . W 1879 roku francuski chemik Édouard Grimaux zsyntetyzował kwas barbiturowy z kwasu malonowego , mocznika i tlenochlorku fosforu (POCl 3 ). Od tego czasu kwas malonowy został zastąpiony malonianem dietylu , ponieważ zastosowanie estru pozwala uniknąć problemu związanego z kwasowością kwasu karboksylowego i jego niereaktywnego karboksylanu .
Nieruchomości
Węgiel α ma reaktywny atom wodoru i jest dość kwaśny (pKa = 4,01) nawet jak na diketony (por. dimedon o pKa 5,23 i acetyloaceton o pKa 8,95) ze względu na dodatkową aromatyczną stabilizację karboanionu.
Używa
Wykorzystując reakcję kondensacji Knoevenagela , kwas barbiturowy może tworzyć wiele różnych leków barbituranów , które działają depresyjnie na ośrodkowy układ nerwowy . Od 2007 roku zsyntetyzowano ponad 2550 barbituranów i związków pokrewnych, z czego 50 do 55 jest obecnie w użyciu klinicznym na całym świecie. Pierwszym stosowanym w medycynie był barbital (Veronal) począwszy od 1903 r., a drugim fenobarbitalem po raz pierwszy wprowadzono na rynek w 1912 r.
Kwas barbiturowy jest chemicznym budulcem w laboratoryjnej syntezie ryboflawiny (witaminy B 2 ) oraz w sposobie wytwarzania farmaceutycznego leku minoksydylu . Jest jednym z czterech składników w syntezie ryboflawiny. Zanim kwas barbiturowy został zastąpiony w syntezie ryboflawiny, synteza ryboflawiny była zbyt kosztowna. Według Cyclopedic Medical Dictionary Tabera przedawkowanie powoduje depresję oddechową, sinicę, zapaść krążeniową, otępienie, śpiączkę i prawdopodobnie śmierć.
Zdrowie i bezpieczeństwo
Przedawkowanie leków zawierających barbiturany może spowodować depresję oddechową i śmierć. Barbiturany powodują uzależnienie, a nagłe odstawienie dużych dawek może spowodować bardzo poważny medycznie, a nawet śmiertelny zespół odstawienia. Pochodne kwasu barbiturowego są uważane za substancje kontrolowane DEA Schedule III.
Zobacz też
Linki zewnętrzne
- Mahmudow, KT; Kopyłowicz, MN; Maharramov, AM; Kurbanowa, MM; Gurbanow, AV; Pombeiro, AJL (2014). „Kwasy barbiturowe jako przydatne narzędzie do budowy związków koordynacyjnych i supramolekularnych”. Recenzje chemii koordynacyjnej . 265 : 1–37. doi : 10.1016/j.ccr.2014.01.002 .