Ledipaswir/sofosbuwir
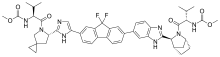 Ledipasvir
| |
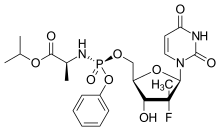 Sofosbuvir struktura
| |
| Kombinacja | |
|---|---|
| ledipaswir | inhibitor NS5A |
| Sofosbuwir | Inhibitor NS5B ( polimerazy RNA ). |
| Dane kliniczne | |
| Nazwy handlowe | Harvoni, Hepcinat-LP, inni |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a614051 |
| Dane licencyjne | |
| Kategoria ciąży |
|
Drogi podawania |
Ustami |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Identyfikatory | |
| Identyfikator klienta PubChem | |
| KEGG | |
| Dane chemiczne i fizyczne | |
| Formuła | C 71 H 83 F 3 N 11 O 15 P |
| Masa cząsteczkowa | 1 418 0,476 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Ledipasvir/sofosbuvir , sprzedawany między innymi pod nazwą handlową Harvoni , jest lekiem stosowanym w leczeniu wirusowego zapalenia wątroby typu C. Jest to połączenie ustalonych dawek ledipaswiru i sofosbuwiru . Wskaźniki wyleczeń wynoszą od 94% do 99% u osób zakażonych wirusem zapalenia wątroby typu C (HCV) o genotypie 1. Niektóre dowody potwierdzają również stosowanie w genotypie 3 i 4 HCV. Lek przyjmuje się codziennie doustnie przez 8–24 tygodni.
Na ogół jest dobrze tolerowany. Częste działania niepożądane obejmują bóle mięśni, ból głowy, nudności, wysypkę i kaszel. Nie jest jasne, czy stosowanie w czasie ciąży jest bezpieczne dla dziecka. Ledipaswir działa poprzez zmniejszanie aktywności NS5A , a sofosbuwir działa poprzez zmniejszanie aktywności polimerazy NS5B .
Ledipasvir / sofosbuvir został zatwierdzony do użytku medycznego w Stanach Zjednoczonych, Unii Europejskiej i Kanadzie w 2014 r. Znajduje się na Liście Podstawowych Leków Światowej Organizacji Zdrowia .
Zastosowania medyczne
Wskaźniki wyleczeń wynoszą od 94% do 99% u osób zakażonych genotypem 1 (46% przypadków HCV). Został również oceniony pod kątem leczenia zakażenia innymi genotypami zapalenia wątroby typu C i wykazał obiecujące wyniki w przypadku genotypów 3 i 4 (stanowiących odpowiednio 30% i mniej niż 22% przypadków HCV).
Opór
mutacje NS5A
replikonów HCV jest koniecznych, aby wywołać znaczący wpływ na oporność z powodu wielu mechanizmów działania. Generalnie genotyp 1a HCV jest mniej odporny na mutację niż genotyp 1b.
W przypadku genotypu 1b pojedyncza substytucja aminokwasu (np. L31V) w replikonie powodowała mniej niż 100-krotny wzrost oporności na ledipaswir w produkcie Harvoni, podczas gdy substytucja dwoma aminokwasami powodowała ponad 1000-krotny wzrost oporności. Genotyp 1a miał podobny, ale bardziej znaczący wzrost oporności z każdym odpowiednim wzrostem podstawienia aminokwasu z podstawieniami związanymi z opornością w K24R, M28T/V, Q30R/H/K/L, L31M i/lub Y93H/N.
Polimorfizmy NS5A mają również wpływ na oporność wirusa, przy czym najczęściej związane z opornością substytucje aminokwasów wykrywane są w Q30R, Y93H lub N i L31M u pacjentów z szybką odpowiedzią wirusologiczną (RVR). Specyficzne początkowe polimorfizmy związane z opornością na NS5A obserwowane w badaniach klinicznych to M28T/V, Q30H, Q30R, L31M, H58P, Y93H i Y93N w genotypie 1a oraz L28M, A92T i Y93H w genotypie 1b. Pacjenci z wieloma początkowymi polimorfizmami NS5A mają zwykle wyższy wskaźnik nawrotów podczas stosowania ledipaswiru/sofosbuwiru. Różnica w częstości nawrotów między grupami wcześniej nieleczonymi a grupami wcześniej leczonymi z wyjściowymi polimorfizmami NS5A wynosi odpowiednio od 1% po 12-tygodniowym schemacie i 0% po 24-tygodniowym schemacie.
mutacje NS5B
Pojedyncza substytucja aminokwasu S282T przyczynia się do oporności wirusa i zmniejsza aktywność sofosbuwiru w ledipaswir/sofosbuwirze o około 2 do 18 razy.
Odporność krzyżowa
Nie zaobserwowano oporności krzyżowej w skojarzeniu ledipaswiru i sofosbuwiru w badaniach klinicznych ION fazy 1, 2 i 3, ponieważ ledipaswir był w pełni aktywny przeciwko substytucjom związanym z opornością na sofosbuwir i odwrotnie.
Skutki uboczne
Ponad 10% osób przyjmujących ledipasvir/sofosbuvir ma bóle głowy lub zmęczenie; wysypki, nudności, biegunka i bezsenność występują u 1% do 10% osób przyjmujących ten lek.
Cięższe reakcje są związane z reakcjami alergicznymi na leki i problemami sercowo-naczyniowymi. Działania niepożądane leku Harvoni są uważane za stosunkowo łagodne w porównaniu ze starszymi metodami leczenia opartymi na interferonie. [ potrzebne źródło ]
Ledipaswir/sofosbuwir może powodować reaktywację wirusowego zapalenia wątroby typu B u osób jednocześnie zakażonych wirusami zapalenia wątroby typu B i C. Europejska Agencja Leków zaleciła przeprowadzenie badań przesiewowych wszystkich osób w kierunku wirusowego zapalenia wątroby typu B przed rozpoczęciem stosowania ledipaswiru/sofosbuwiru w kierunku wirusowego zapalenia wątroby typu C w celu zminimalizowania ryzyka reaktywacji wirusowego zapalenia wątroby typu B.
Interakcje leków
Ledipaswir/sofosbuwir jest substratem dla transporterów leków glikoproteiny P (P-gp) i białka oporności raka piersi (BCRP). Wchłanianie jelitowe tych substratów transporterów leków może być zmniejszone przez induktory, takie jak ryfampicyna i ziele dziurawca .
Pacjentom zaleca się również unikanie antagonistów receptora H 2 (H2RA) i inhibitorów pompy protonowej (PPI), ponieważ zmniejszają one stężenie ledipaswiru (jego rozpuszczalność zależy od pH i jest większa w środowisku kwaśnym). Dlatego zaleca się przyjmowanie PPI co najmniej dwie godziny po ledipaswirze/sofosbuwirze w dawce mniejszej lub równej 20 mg na dobę i H2RA w dawce mniejszej lub równej 40 mg dwa razy na dobę.
Ledipaswiru/sofosbuwiru należy dodatkowo unikać podczas przyjmowania amiodaronu lub innych leków zmniejszających częstość akcji serca; istnieje poważne ryzyko lub zatrzymania akcji serca , gdy ledipaswir/sofosbuwir jest stosowany z takimi lekami.
Mechanizmy działania
Najczęściej związanym mechanizmem związanym z ledipaswirem/sofosbuwirem jest hiperfosforylacja NS5A , polimerazy wirusowej ważnej w prawidłowym składaniu wirusa i zaburzającej prawidłowy metabolizm wątroby. Ledipaswir/sofosbuwir hamuje prawidłowe składanie wirusa poprzez zmianę położenia lokalizacji subkomórkowej NS5A.
NS5B , wirusowa polimeraza, która może inicjować syntezę RNA de novo , jest również hamowana allosterycznie przez ledipaswir/sofosbuwir.
Inhibitory NS5A i NS5B w połączeniu mają działanie synergistyczne.
Farmakokinetyka
Sofosbuwir szybko wchłania się w osoczu, osiągając maksymalne stężenie (Cmax) po 0,8 do 1 godziny po podaniu dawki i podlega metabolizmowi pozawątrobowemu, w którym 61 do 65% wiąże się z białkami osocza ludzkiego . Następnie jest głównie przekształcany w nieaktywny krążący metabolit wolny od fosforanów GS-331007 (eliminowany w 76% przez bierną filtrację nerkową), którego mediana maksymalnego stężenia w osoczu występuje po 3,5 do 4 godzin po przyjęciu leku. Wydaje się, że na Sofosbuvir nie mają wpływu różne poziomy makroskładników odżywczych w porównaniu ze stanami na czczo .
Maksymalne stężenie ledipaswiru występuje po 4 do 4,5 godziny po spożyciu i makroskładniki odżywcze nie mają na niego wpływu. Wiąże się z białkami w ponad 98% i jest wydalany głównie z kałem, przy minimalnym metabolizmie w wątrobie.
Eliminacja
Mediana końcowego okresu półtrwania po podaniu ledipaswiru/sofosbuwiru w dawce 90 mg [14C]-ledipaswiru wynosi 47 godzin; dla 400 mg [14C]-Sofosbuviru jest to 0,5 godziny (po wstępnej dystrybucji leku w tkankach) i 27 godzin (ostateczne wydalenie leku).
| Substancja | ng/ml |
|---|---|
| ledipaswir | 323 |
| Sofosbuwir | 618 |
| GS-331007 | 707 |
Uwaga: maksymalne stężenie jest o 32% wyższe u osób zdrowych niż zakażonych wirusem zapalenia wątroby typu C.
| Substancja | ng*godz./ml |
|---|---|
| ledipaswir | 7290 |
| Sofosbuwir | 1320 |
| GS-33107 | 12 000 |
Uwaga: Maksymalne stężenie jest o 24% wyższe u osób zdrowych niż zakażonych wirusem zapalenia wątroby typu C.
Wykrywanie krwi
Opracowano metodę analityczną opartą na LC tandem MS w celu jednoczesnej ekstrakcji i oznaczania ledipaswiru/sofosbuwiru w ludzkim osoczu przy użyciu przeciwwirusowego daklataswiru jako wzorca wewnętrznego. Średni odzysk po ekstrakcji dla sofosbuwiru i ledipaswiru wynosił odpowiednio 91,61% i 88,93%.
Społeczeństwo i kultura
Jednym z producentów jest Gilead Sciences .
Linki zewnętrzne
- „Mieszanina ledipaswiru z sofosbuwirem” . Portal informacyjny o lekach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.