ledipaswir
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Harvoni (połączenie z sofosbuwirem ) |
| Inne nazwy | GS-5885 |
| Dane licencyjne | |
Drogi podawania |
Ustami |
| Kod ATC |
|
| Status prawny | |
| Status prawny |
|
| Dane farmakokinetyczne | |
| Biodostępność | 76% |
| Wiązanie białek | >99% |
| Metabolizm | Brak metabolizmu cytochromu |
| Okres półtrwania w fazie eliminacji | 47 godz |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| Bank Leków | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Dane chemiczne i fizyczne | |
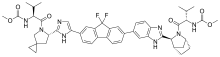
| Formuła | C 49 H 54 F 2 N 8 O 6 |
| Masa cząsteczkowa | 889,018 g · mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Ledipasvir to lek do leczenia wirusowego zapalenia wątroby typu C opracowany przez firmę Gilead Sciences . Po zakończeniu badań klinicznych fazy III , w dniu 10 lutego 2014 r. firma Gilead złożyła wniosek o zatwierdzenie w USA tabletki złożonej ledipaswiru/sofosbuwiru o ustalonej dawce do leczenia wirusowego zapalenia wątroby typu C o genotypie 1. Połączenie ledipaswiru/sofosbuwiru jest bezpośrednio działającym środkiem przeciwwirusowym, który wpływa na HCV replikacji i może być stosowany do leczenia pacjentów z genotypem 1a lub 1b bez PEG-interferonu lub rybawiryny .
Ledipaswir jest inhibitorem NS5A , białka wirusa zapalenia wątroby typu C. [ potrzebne źródło ]
Dane przedstawione na 20. Konferencji na temat Retrowirusów i Zakażeń Oportunistycznych w marcu 2013 r. wykazały, że potrójny schemat z analogiem nukleotydu , inhibitorem sofosbuwirem, ledipaswirem i rybawiryną , dawał 12-tygodniowy wskaźnik trwałej odpowiedzi wirusologicznej (SVR12) po leczeniu dla obu wcześniej nieleczeni pacjenci i osoby z genotypem 1 HCV, u których nie wystąpiła odpowiedź na leczenie. Kombinacja sofosbuwiru/ledipaswiru jest testowana z rybawiryną i bez rybawiryny. W lutym 2014 r. firma Gilead złożyła wniosek o zatwierdzenie przez Amerykańską Agencję ds. Żywności i Leków (FDA) doustnego leczenia ledipaswirem/sofosbuwirem, bez interferonu i rybawiryny.
W dniu 10 października 2014 r. FDA zatwierdziła złożony produkt ledipasvir / sofosbuvir o nazwie Harvoni .
Zastosowania medyczne
Ledipaswir jest najczęściej stosowany w połączeniu z sofosbuwirem w leczeniu pacjentów z przewlekłym wirusowym zapaleniem wątroby typu C o genotypie 1. Ten lek został przetestowany i wykazano jego skuteczność u pacjentów wcześniej nieleczonych i leczonych wcześniej.
Niekorzystne skutki
Według badań klinicznych ledipaswir/sofosbuwir był bardzo dobrze tolerowany, a najczęstszymi działaniami niepożądanymi były zmęczenie i ból głowy.
Interakcje
Większość interakcji lekowych z produktem Harvoni dotyczy induktorów Pgp , takich jak ziele dziurawca lub ryfampicyna . Jednoczesne stosowanie zmniejsza stężenie leku Harvoni we krwi, a tym samym zmniejsza działanie terapeutyczne.
Mechanizm akcji
Ledipaswir hamuje ważną wirusową fosfoproteinę, NS5A , która bierze udział w replikacji, składaniu i wydzielaniu wirusa.
Z drugiej strony, sofosbuwir jest metabolizowany do mimetyku trifosforanu urydyny , który po włączeniu do RNA przez polimerazę NS5B działa jako terminator łańcucha RNA .
Koszt
Podobnie jak w przypadku sofosbuviru, koszt Harvoni był kontrowersyjnym tematem. Kosztuje 1125 USD za pigułkę w USA, co przekłada się na 63 000 USD za 8-tygodniowy kurs leczenia, 94 500 USD za 12-tygodniowy kurs leczenia lub 189 000 USD za 24-tygodniowy kurs leczenia. Gilead uzasadnia koszty, przewyższając korzyści płynące z leczenia wirusowego zapalenia wątroby typu C nad kosztami podwójnych wydatków na przeszczepy wątroby lub tymczasowe leczenie chorób wątroby. Firma Gilead zapewniła program pomocy dotyczący ledipaswiru/sofosbuwiru dla kwalifikujących się pacjentów z niedostatecznym ubezpieczeniem lub niedostatecznie ubezpieczonych pacjentów z wirusowym zapaleniem wątroby typu C, których nie stać na pokrycie kosztów leczenia.
W lipcu 2015 r. Gilead zmodyfikował kryteria uprawniające do otrzymywania świadczeń Ścieżki Wsparcia dla pacjentów zakażonych HCV w Stanach Zjednoczonych. [ potrzebne źródło ]