Septin
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| podziału komórkowego/białka wiążącego GTP | |||||||||
| Symbol | Cell_Div_GTP_bd | ||||||||
| Pfam | PF00735 | ||||||||
| Klan Pfam | CL0023 | ||||||||
| InterPro | IPR000038 | ||||||||
| |||||||||
Septyny to grupa białek wiążących GTP , których ekspresja występuje we wszystkich komórkach eukariotycznych z wyjątkiem roślin . Różne septyny tworzą ze sobą kompleksy białkowe . Kompleksy te mogą dalej łączyć się we włókna, pierścienie i gazy. Zmontowane jako takie, septyny działają w komórkach poprzez lokalizowanie innych białek , albo przez zapewnienie rusztowania, do którego białka mogą się przyczepić, albo przez tworzenie bariery zapobiegającej dyfuzji cząsteczek z jednego przedziału komórki do drugiego, albo w kora komórkowa jako bariera dla dyfuzji białek związanych z błoną.
Septyny biorą udział w lokalizacji procesów komórkowych w miejscu podziału komórki oraz w błonie komórkowej w miejscach, w których wyspecjalizowane struktury, takie jak rzęski lub wici , są przyczepione do ciała komórki. W komórkach drożdży dzielą części komórki i budują rusztowania, aby zapewnić wsparcie strukturalne podczas podziału komórki w przegrodzie , od której wywodzą swoją nazwę. Badania na ludzkich komórkach sugerują, że septyny budują klatki wokół patogennych bakterii , które unieruchamiają je i zapobiegają inwazji innych komórek.
Jako białka tworzące włókna septyny można uznać za część cytoszkieletu . Oprócz tworzenia włókien niepolarnych, septyny łączą się z błonami komórkowymi , korą komórkową, włóknami aktynowymi i mikrotubulami .
Struktura
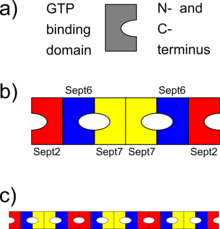
a) schemat cząsteczki septyny z domeną wiążącą GTP po jednej stronie i końcami N i C łańcucha polipeptydowego po drugiej b ) schemat heteroheksamerycznego kompleksu septyny (septin ludzkich), gdzie różne septyny wiążą się ze sobą poprzez wiązanie GTP domen lub przez końcówki N i C. Zwróć uwagę na symetrię kompleksu c) schematycznie, w jaki sposób kompleksy septyny mogą się ustawiać, tworząc włókna septyny
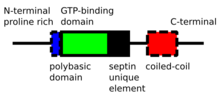
Septyny to białka P-Loop -NTPazy o masie od 30 do 65 kDa. Septiny są wysoce konserwatywne między różnymi gatunkami eukariotycznymi. Składają się z N-końca bogatego w prolinę o zmiennej długości z podstawowym motywem wiążącym fosfoinozytyd , ważnym dla asocjacji z błoną, domeny wiążącej GTP , wysoce konserwatywnej domeny elementu unikalnego Septin i C-końcowego przedłużenia obejmującego domenę typu coiled coil zmienna długość.
Septiny oddziałują albo poprzez swoje odpowiednie domeny wiążące GTP, albo przez ich N- i C-końce. Różne organizmy wyrażają różną liczbę septyn iz tych symetrycznych oligomerów powstają. Na przykład u drożdży utworzony kompleks oktameryczny to Cdc11-Cdc12-Cdc3-Cdc10-Cdc10-Cdc3-Cdc12-Cdc11. U ludzi możliwe są kompleksy heksameryczne lub oktameryczne. Początkowo wskazano, że ludzki kompleks to Sept7-Sept6-Sept2-Sept2-Sept6-Sept7; ale ostatnio ta kolejność została zmieniona na Sept2-Sept6-Sept7-Sept7-Sept6-Sept2 (lub Sept2-Sept6-Sept7-Sept3-Sept3-Sept7-Sept6-Sept2 w przypadku oktamerycznych heterooligomerów). Kompleksy te następnie łączą się, tworząc niepolarne włókna, wiązki włókien, klatki lub struktury pierścieniowe w komórkach.
Występowanie
Septiny znajdują się w grzybach , zwierzętach i niektórych algach eukariotycznych , ale nie występują w roślinach.
| Gatunek | Grupa ( filogenetyczna ) | geny septyny | |
|---|---|---|---|
| Grzyby | Saccharomyces cerevisiae | Cdc3 | Cdc3 |
| Cdc10 | Cdc10 | ||
| Cdc11 | Cdc11, Shs1, Spr28 | ||
| Cdc12 | Cdc12, Spr3 | ||
| Schizosaccharomyces pombe | Spn1 | Spn1 | |
| Spn2 | Spn2 | ||
| Spn3 | Spn3, Spn5, Spn7 | ||
| Spn4 | Spn4, Spn6 | ||
| Candida albicans | Cdc3 | Cdc3 | |
| Cdc10 | Cdc10 | ||
| Cdc11 | Cdc11, 7 września, 28 września | ||
| Cdc12 | Cdc12, Spr3 | ||
| Aspergillus nidulan | AspD | AspD | |
| AspB | AspB | ||
| SPA | SPA | ||
| AspC | AspC | ||
| AspE | AspE | ||
| Zwierząt | ludzie | 2 września | 1 września, 2 września, 4 września, 5 września |
| 3 września | 3 września, 9 września, 12 września | ||
| 6 września | 6 września, 8 września, 10 września, 11 września, 14 września | ||
| 7 września | 7 września (13 września jako pseudogen) | ||
| Caenorhabditis elegans | UNC-59 | UNC-59 | |
| UNC-61 | UNC-61 |
W drożdżach
Septiny w Saccharomyces cerevisiae (mikrofotografia fluorescencyjna) • Zielony: septyny ( AgSEP7- GFP ) • Czerwony: zarys komórki ( kontrast fazowy ) • Pasek skali: 10 μm
Istnieje siedem różnych septyn w Saccharomyces cerevisiae . Pięć z nich bierze udział w mitozie, a dwa (Spr3 i Spr28) są specyficzne dla sporulacji . Septiny mitotyczne (Cdc3, Cdc10, Cdc11, Cdc12, Shs1) tworzą strukturę pierścieniową na szyjce pąka podczas podziału komórki . Biorą udział w selekcji miejsca pąków, pozycjonowaniu wrzeciona mitotycznego , spolaryzowanym wzroście i cytokinezie . Zarodnikujące przegrody (Spr3, Spr28) lokalizują się wraz z Cdc3 i Cdc11 na brzegach błon prosporowych.
Organizacja
Septiny tworzą wyspecjalizowany region w korze komórkowej znany jako kora septynowa. Kora przegrody przechodzi kilka zmian w trakcie cyklu komórkowego : Pierwszą widoczną strukturą przegrody jest wyraźny pierścień, który pojawia się ~15 minut przed pojawieniem się pąków . Po pąków pierścień rozszerza się i przybiera kształt klepsydry wokół szyi pąka matki. Podczas cytokinezy kora przegrody dzieli się na podwójny pierścień, który ostatecznie znika. W jaki sposób kora przegrody może ulegać tak dramatycznym zmianom, chociaż niektóre z jej funkcji mogą wymagać, aby była stabilną strukturą? FRAP ujawniła, że rotacja przegród na szyi podlega wielokrotnym zmianom podczas cyklu komórkowego . Dominująca, funkcjonalna konformacja charakteryzuje się niskim tempem obrotu (stan zamrożony), podczas którego dochodzi do fosforylacji septyn . Zmiany strukturalne wymagają destabilizacji kory przegrody (stan płynny) wywołanej przez defosforylację przed pąków , pękanie słojów i separacja komórek .
Skład kory przegrody zmienia się nie tylko w trakcie cyklu komórkowego , ale także wzdłuż osi pączek-matka. Ta polaryzacja sieci septynowej umożliwia koncentrację niektórych białek głównie po matczynej stronie szyi, niektórych w środku, a innych w miejscu pąków .
Funkcje
Szafot
Septiny działają jak rusztowanie, rekrutując wiele białek . Te kompleksy białkowe biorą udział w cytokinezie , odkładaniu chityny , polaryzacji komórek , tworzeniu zarodników , w punkcie kontrolnym morfogenezy , punkcie kontrolnym wyrównania wrzeciona i wyborze miejsca pąków.
Cytokineza
cytokineza drożdży jest napędzana dwoma redundantnymi procesami zależnymi od septyny: rekrutacją i skurczem pierścienia aktomiozyny oraz tworzeniem przegrody przez fuzję pęcherzyków z błoną plazmatyczną . W przeciwieństwie do mutantów septynowych , przerwanie pojedynczej ścieżki prowadzi tylko do opóźnienia cytokinezy , a nie do całkowitego niepowodzenia podziału komórki . W związku z tym przewiduje się, że septyny będą działać na najwyższym poziomie cytokinezy .
Polaryzacja komórki
Po zamianie izotropowo - wierzchołkowej w pączkujących drożdżach składniki korowe , przypuszczalnie egzocysty i polarysomu , są przenoszone z bieguna wierzchołkowego do całej błony plazmatycznej pąka, ale nie do komórki macierzystej. Pierścień septyny na szyi służy jako bariera korowa, która zapobiega dyfuzji błonowej tych czynników między dwoma przedziałami. Ta asymetryczna dystrybucja jest zniesiona w mutantach septyny .
Niektóre warunkowe mutanty septyny nie tworzą pąków w ich normalnym położeniu osiowym. Co więcej, typowa lokalizacja niektórych czynników selekcji miejsca pąków w podwójnym pierścieniu na szyi jest utracona lub zaburzona u tych mutantów . Wskazuje to, że septyny mogą służyć jako miejsce zakotwiczenia takich czynników w pączkujących osiowo .
U grzybów nitkowatych
Od czasu ich odkrycia w S. cerevisiae homologi septyny znaleziono u innych gatunków eukariotycznych , w tym grzybów nitkowatych . Septyny grzybów nitkowatych wykazują różnorodne kształty w obrębie pojedynczych komórek , gdzie kontrolują aspekty morfologii nitkowatych .
Candida albicans
Genom C. albicans koduje homologi wszystkich septyn S. cerevisiae . Bez genów Cdc3 i Cdc12 Candida albicans nie może się rozmnażać, inne septyny wpływają na morfologię i odkładanie chityny , ale nie są niezbędne. Candida albicans może wykazywać różne morfologie wzrostu wegetatywnego, co determinuje wygląd struktur septynowych. Nowo tworzące się strzępki tworzą pierścień septyny u podstawy, podwójne pierścienie tworzą się w miejscach przegrody strzępek, a czapeczka septyny tworzy się na końcach strzępek. Wydłużone włókna septynowe otaczają kuliste chlamydospory . Podwójne pierścienie przegród w miejscu przegrody również mają polaryzację wzrostu, z demontażem rosnącego pierścienia wierzchołkowego, podczas gdy pierścień podstawowy pozostaje nienaruszony.
Aspergillus nidulan
A. nidulans znajduje się pięć septyn (AnAspAp, AnAspBp, AnAspCp, AnAspDp, AnAspEp). AnAspBp tworzy pojedyncze pierścienie w miejscach przegród, które ostatecznie dzielą się na podwójne pierścienie. Dodatkowo AnAspBp tworzy pierścień w miejscach wyłaniania się gałęzi, który rozszerza się w pasmo w miarę wzrostu gałęzi. Podobnie jak u C. albicans , podwójne pierścienie odzwierciedlają biegunowość strzępki . W przypadku Aspergillus nidulans polarność jest przenoszona przez demontaż bardziej podstawowego pierścienia (pierścień dalej od końcówki wzrostu strzępki), pozostawiając nienaruszony pierścień wierzchołkowy, potencjalnie jako wskazówka prowadząca do wzrostu.
Ashbya gossypii

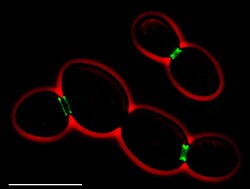
Septiny w Ashbya gossypii (mikrofotografia fluorescencyjna) • Zielony: septyny ( AgSEP7- GFP ) • Czerwony: zarys komórek ( kontrast fazowy ) • Wkładka: rekonstrukcja 3D nieciągłego pierścienia septynowego • Paski skali: 10 μm
Ascomycete których jedna jest zduplikowana ( A. gossypii posiada homologi do wszystkich septyn S. cerevisiae , z AgCDC3, AgCDC10, AgCDC11A, AgCDC11B, AgCDC12, AgSEP7 ). Badania in vivo AgSep7p- GFP ujawniły, że przegrody gromadzą się w nieciągłe pierścienie strzępek w pobliżu rosnących wierzchołków i miejsc formowania rozgałęzień oraz w struktury asymetryczne u podstawy punktów rozgałęzień. Pierścienie wykonane są z włókien które są długie i rozproszone blisko rosnących wierzchołków oraz krótkie i zwarte dalej od wierzchołka. Podczas formowania przegrody pierścień septyny dzieli się na dwa, tworząc podwójny pierścień. Mutanty delecyjne Agcdc3Δ, Agcdc10Δ i Agcdc12Δ wykazują nieprawidłową morfologię i są wadliwe pod względem tworzenia pierścienia aktyny , tworzenia pierścienia chitynowego i sporulacji . Ze względu na brak septy mutanty delecyjne septyny są bardzo wrażliwe, a uszkodzenie pojedynczej strzępki może spowodować całkowitą lizę młodej grzybni .
u zwierząt
W przeciwieństwie do septyn u drożdży iw przeciwieństwie do innych składników cytoszkieletu zwierząt, septyny nie tworzą ciągłej sieci w komórkach, ale kilka rozproszonych sieci w cytoplazmie kory komórkowej . Są one zintegrowane z aktynowymi i mikrotubulami . Na przykład anilina wiążąca aktynę jest wymagana do prawidłowej przestrzennej kontroli organizacji septyny. W plemnikach ssaków _ , septyny tworzą stabilny pierścień zwany pierścieniem w ogonie. U myszy (a potencjalnie także u ludzi) wadliwe tworzenie się pierścienia prowadzi do niepłodności męskiej.
Człowiek
U ludzi septyny biorą udział w cytokinezie , tworzeniu rzęsek i neurogenezie poprzez zdolność do rekrutacji innych białek lub służą jako bariera dyfuzyjna. Istnieje 13 różnych ludzkich genów kodujących septyny. Białka septyny wytwarzane przez te geny są pogrupowane w cztery podrodziny, z których każda nosi nazwę członka założyciela: (i) SEPT2 ( SEPT1 , SEPT4 , SEPT5 ), (ii) SEPT3 ( SEPT9 , SEPT12 ), (iii) SEPT6 ( SEPT8 , SEPT10 , SEPT11 , SEPT14 ) i (iv) SEPT7 . Kompleksy białkowe septyny składają się w heteroheksamery ( zawierające monomery wybrane z trzech różnych grup, a monomer z każdej grupy występuje w dwóch kopiach; 3 x 2 = 6) lub heterooktamery ( monomery z czterech różnych grup, każdy monomer występuje w dwóch egzemplarzach; 4 x 2 = 8). Te heterooligomery z kolei tworzą struktury wyższego rzędu, takie jak włókna i pierścienie.
Septiny tworzą struktury przypominające klatki wokół patogenów bakteryjnych , unieruchamiając szkodliwe drobnoustroje i zapobiegając ich inwazji na zdrowe komórki. Ten komórkowy system obronny mógłby potencjalnie zostać wykorzystany do stworzenia terapii na czerwonkę i inne choroby . Na przykład Shigella jest bakterią wywołującą śmiertelną biegunkę u ludzi. Aby rozmnażać się z komórki do komórki, Shigella rozwijają aktynę - polimer „ogony”, które napędzają drobnoustroje i pozwalają im dostać się do sąsiednich komórek gospodarza. W ramach odpowiedzi immunologicznej komórki ludzkie wytwarzają białko sygnalizacyjne o nazwie TNF-α , które wyzwala grube wiązki włókien septynowych, które otaczają drobnoustroje w zakażonej komórce gospodarza. Drobnoustroje, które zostają uwięzione w tych septynowych klatkach, są rozkładane przez autofagię . Zakłócenia w septinach i mutacje w genach , które je kodują, mogą być zaangażowane w wywoływanie białaczki , raka okrężnicy i chorób neurodegeneracyjnych, takich jak Choroba Parkinsona i choroba Alzheimera . Potencjalne terapie tych, jak również chorób bakteryjnych, takich jak czerwonka wywołana przez Shigella , mogą wzmocnić układ odpornościowy organizmu za pomocą leków , które naśladują zachowanie TNF-α i umożliwiają namnażanie się klatek septynowych.
Caenorhabditis elegans
W nicieniach Caenorhabditis elegans występują dwa geny kodujące septyny, a kompleksy septyn zawierają dwie różne septyny w tetramerycznym kompleksie UNC59-UNC61-UNC61-UNC59. Septyny w C.elegans koncentrują się w bruździe bruzdowej i środkowej części wrzeciona podczas podziału komórki . Septyny są również zaangażowane w migrację komórek i kierowanie aksonami u C.elegans .
W mitochondriach
Septyna zlokalizowana w mitochondriach nazywana jest septyną mitochondrialną (M-septin). Zostało zidentyfikowane jako CRMP /CRAM w rozwijającym się mózgu szczura.
Historia
Septiny zostały odkryte w 1970 roku przez Lelanda H. Hartwella i współpracowników w badaniach przesiewowych mutantów wrażliwych na temperaturę wpływających na podział komórek (mutanty cdc) w drożdżach ( Saccharomyces cerevisiae ). Ekran ujawnił cztery mutanty, które zapobiegały cytokinezie w restrykcyjnej temperaturze. Odpowiednie geny reprezentują cztery oryginalne septyny, ScCDC3, ScCDC10, ScCDC11 i ScCDC12 . Pomimo zakłócenia cytokinezy komórki nadal pączkowały , Synteza DNA i podział jądrowy , w wyniku którego powstały duże komórki wielojądrowe z wieloma wydłużonymi pąkami. W 1976 roku analiza mikrografów elektronowych ujawniła około 20 równomiernie rozmieszczonych prążków 10-nm włókien wokół szyjki pąka macierzystego w komórkach typu dzikiego, ale nie w komórkach zmutowanych septyną. Badania immunofluorescencyjne wykazały, że białka septyny kolokalizują się w pierścień septyny na szyi. Lokalizacja wszystkich czterech septin jest zakłócona w warunkowych Sccdc3 i Sccdc12 , wskazujące na współzależność białek septyny. Silnego wsparcia dla tego odkrycia dostarczyły biochemiczne : cztery oryginalne septyny wspólnie oczyszczone na kolumnach powinowactwa , razem z piątym białkiem septyny, kodowanym przez ScSEP7 lub ScSHS1 . Oczyszczone septyny z pączkujących drożdży, Drosophila , Xenopus i komórek ssaków są zdolne do samodzielnego asocjacji in vitro , tworząc włókna. Jak septini wchodzą w interakcje in vitro w celu utworzenia heterooligomerów , które składają się we włókna, badano szczegółowo w S. cerevisiae .
Mikrofotografie oczyszczonych włókien wykazały możliwość, że przegrody są zorganizowane równolegle do osi pąka macierzystego. Prążki 10 nm widoczne na mikrografach elektronowych mogą być wynikiem bocznej interakcji między włóknami. Zmutowane szczepy pozbawione czynników ważnych dla organizacji septyny potwierdzają ten pogląd. Zamiast ciągłych pierścieni septyny tworzą słupki zorientowane wzdłuż osi pąka macierzystego w mutantach delecyjnych ScGIN4, ScNAP1 i ScCLA4 .
Dalsza lektura
- Güler GÖ, Mostowy S (marzec 2023). „Cytoszkielet septyny: skład heteromeru określa funkcję włókna” . Journal of Cell Biology . 222 (3): e202302010–e202302010. doi : 10.1083/jcb.202302010 . PMID 36821087 .
- Longtine MS, DeMarini DJ, Valencik ML, Al-Awar OS, Fares H, De Virgilio C, Pringle JR (luty 1996). „The septins: role w cytokinezie i innych procesach” . bież. Opinia. Biol komórkowy . 8 (1): 106–19. doi : 10.1016/S0955-0674(96)80054-8 . PMID 8791410 .
- Faty M, Fink M, Barral Y (czerwiec 2002). „Septins: pierścień rozstania z matką i córką” . bież. Genet . 41 (3): 123–31. doi : 10.1007/s00294-002-0304-0 . PMID 12111093 . S2CID 22744214 .
- Versele M, Gullbrand B, Shulewitz MJ, Cid VJ, Bahmanyar S, Chen RE, Barth P, Alber T, Thorner J (październik 2004). „Interakcje białko-białko regulujące składanie heteropentameru septyny i organizację włókien septyny w Saccharomyces cerevisiae” . Mol. Biol. komórka . 15 (10): 4568–83. doi : 10.1091/mbc.E04-04-0330 . PMC 519150 . PMID 15282341 .
- Douglas LM, Alvarez FJ, McCreary C, Konopka JB (wrzesień 2005). „Funkcja septyny w systemach modelowych drożdży i grzybów chorobotwórczych” . Komórka eukariotyczna . 4 (9): 1503–12. doi : 10.1128/EC.4.9.1503-1512.2005 . PMC 1214204 . PMID 16151244 .
- Gladfelter AS (marzec 2006). „Kontrola kształtu komórek grzybów nitkowatych przez przegrody i forminy”. Nat. Wielebny Microbiol . 4 (3): 223–9. doi : 10.1038/nrmicro1345 . PMID 16429163 . S2CID 40080522 .
- Sala PA; Russell SEH; Pringle JR (2008). Septiny . Oksford: John Wiley-Blackwell. P. 370. ISBN 978-0-470-51969-1 .
- Gonzalez-Novo A; Vázquez de Aldana CR; Jimenez J (2009). „Grzybowe septyny: jeden pierścień, by rządzić wszystkim?” . Cent. Eur. J. Biol . 4 (3): 274–289. doi : 10.2478/s11535-009-0032-2 .