acetylooctan etylu

|
|
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
3-oksobutanian etylu |
|
Inne nazwy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.005.015 |
| Numer WE |
|
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS |
|
| UNII | |
| Numer ONZ | 1993 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C6H10O3 _ _ _ _ _ | |
| Masa cząsteczkowa | 130,14 g/mol |
| Wygląd | Bezbarwna ciecz |
| Zapach | Owoce lub rum |
| Gęstość | 1,021 g/cm3 , ciecz |
| Temperatura topnienia | -45 ° C (-49 ° F; 228 K) |
| Temperatura wrzenia | 180,8 ° C (357,4 ° F; 453,9 K) |
| 2,86 g/100 ml (20 °C) | |
| Kwasowość ( p Ka ) |
|
| −71,67×10 −6 cm3 / mol | |
| Zagrożenia | |
| Oznakowanie GHS : | |

|
|
| Ostrzeżenie | |
| H319 | |
| P305+P351+P338 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | 70 ° C (158 ° F; 343 K) |
| Związki pokrewne | |
|
Powiązane estry
|
|
|
Związki pokrewne
|
|
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Organiczny związek acetylooctan etylu ( EAA ) jest estrem etylowym kwasu acetylooctowego . Jest to bezbarwna ciecz. Jest szeroko stosowany jako półprodukt chemiczny w produkcji szerokiej gamy związków. Stosowany jest jako przyprawa do potraw .
Przygotowanie
Acetylooctan etylu jest wytwarzany przemysłowo przez traktowanie diketenu etanolem .
Przygotowanie acetylooctanu etylu jest klasyczną procedurą laboratoryjną. Otrzymuje się go przez kondensację Claisena octanu etylu . Dwa mole octanu etylu skraplają się, tworząc po jednym molu acetylooctanu etylu i etanolu.
Reaktywność
Kwasowość
Acetooctan etylu jest diprotyczny:
- CH3C (O) CH2CO2Et + NaH → CH3C ( ) CH(Na)CO2Et + H2CH3C ( O) CH (
- O Na)CO2Et + BuLi → LiCH2C ( O)CH(Na)CO2Et + BuH
Tautomeria keto-enolowa
Acetooctan etylu podlega tautomerii keto-enolowej . W czystej cieczy o temperaturze 33 ° C enol stanowi 15% całości.
Wielowęglowy blok budulcowy
Kwas etyloacetooctowy jest budulcem w syntezie organicznej, ponieważ protony alfa do grup karbonylowych są kwasowe, a powstały karboanion ulega podstawieniu nukleofilowemu . Acetooctan etylu jest często stosowany w syntezie estru acetylooctowego , podobnie jak malonian dietylu w syntezie estru malonowego lub kondensacji Knoevenagela . Możliwa jest również późniejsza dekarboksylacja termiczna .
Dian acetylooctanu etylu jest również użytecznym budulcem, z wyjątkiem tego, że elektrofil dodaje się do końcowego węgla. Strategię można przedstawić w następującej uproszczonej formie:
- LiCH2C (O)CH(Na)CO2Et + RX → RCH2C ( O)CH(Na) CO2Et + LiX
Ligand
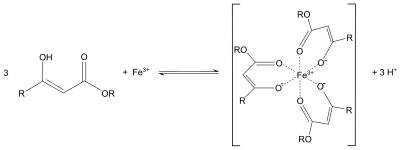
Podobnie do zachowania acetyloacetonu , enolan acetylooctanu etylu może również służyć jako dwukleszczowy ligand. Na przykład tworzy fioletowe kompleksy koordynacyjne z solami żelaza (III):
Zmniejszenie
Redukcja acetylooctanu etylu daje 3-hydroksymaślan etylu.
Transestryfikacja
Acetylooctan etylu transestryfikuje, dając acetylooctan benzylu poprzez mechanizm z udziałem acetyloketenu. Acetylooctany etylu (i inne) łatwo nitrozują równomolowym azotynem sodu w kwasie octowym, dając odpowiednie estry oksyminoacetooctanowe. Redukcja cynkowo-rozpuszczalna tych związków w kwasie octowym w obecności ketoestrów lub beta-diketonów stanowi syntezę pirolu Knorra , przydatną do wytwarzania porfiryn .
Zobacz też
- Frukton , ketal glikolu etylenowego z acetooctanu etylu, związek aromatyczny