disiloksan
|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
disiloksan
|
|
| Inne nazwy Eter disilowy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| Skróty | DS
|
| CHEBI | |
| ChemSpider | |
| 1206 | |
| Siatka | disiloksan |
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| H 6 O Si 2 | |
| Masa cząsteczkowa | 78,217 g · mol -1 |
| Wygląd | Bezbarwny gaz |
| Temperatura wrzenia | -15,2 ° C (4,6 ° F; 257,9 K) |
| 0,24 D | |
| Struktura | |
| Rombowy | |
| Pmm 2 | |
| Zgięty | |
| Zagrożenia | |
| NFPA 704 (ognisty diament) | |
| Związki pokrewne | |
|
Związki pokrewne
|
Eter dimetylowy |
| Strona z danymi uzupełniającymi | |
| Disiloksan (strona z danymi) | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
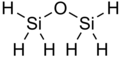
Disiloksan ma wzór chemiczny Si
2 H
6 O . Jest to najprostszy znany siloksan z grupami R zawierającymi tylko atom wodoru. Cząsteczka zawiera sześć równoważnych wiązań Si-H i dwa równoważne wiązania Si-O. W standardowych warunkach disiloksan występuje jako bezbarwny, ostry gaz. Jednak jest ogólnie bezpieczny dla ludzi, co świadczy o jego powszechnym stosowaniu w kosmetykach. Jest również powszechnie znany jako eter disililowy, tlenek disililu i perhydrodisiloksan
Struktura
Disiloksan ma prostą strukturę, która składa się z wiązania siloksanowego (Si–O–Si) i wodorowych grup R.
Strukturę disiloksanu badano różnymi metodami spektroskopowymi, takimi jak dyfrakcja elektronów , krystalografia rentgenowska , moment dipolowy i spektroskopia magnetycznego rezonansu jądrowego . Ze względu na ich niezwykły charakter kąty wiązań Si – O – Si są powszechnie badane. Wiązania te zazwyczaj wykazują kąty większe niż przeciętnie, około 130 do 160 stopni, a większe długości wiązań nie są rzadkością. Na przykład w stanie stałym w temperaturze 108 K sam disiloksan ma kąt wiązania Si – O – Si wynoszący 142 °. Natomiast kąt wiązania C – O – C w węglowym analogu disiloksanu, eter dimetylowy wynosi 111°.
Niezwykły kąt wiązania w disiloksanie został przypisany przede wszystkim ujemnej hiperkonjugacji między p i orbitalami tlenowymi orbitalami antywiążącymi krzem-węgiel σ* , p (O) → σ*(Si⋯–R), formą wiązania wstecznego π . Wtórny i znacznie mniejszy wkład w wiązanie krzem-tlen w disiloksanach obejmuje wiązanie wsteczne π z orbitali tlenu 2 p do orbitali krzemu 3 d , p (O) → d (Si). Z powodu tej interakcji wiązania Si – O mogą wykazywać pewne zachowanie częściowego wiązania podwójnego, a atomów tlenu jest znacznie mniej zasadowy niż w analogu węgla, eterze dimetylowym.
Oprócz badań kątów wiązań przeprowadzono również analizy wibracyjne w celu określenia elementów symetrii disiloksanu. Do zaproponowania grupy punktów D 3d wykorzystano spektroskopię IR i Ramana . [ potrzebne źródło ]
Podczas gdy sam disiloksan ma zakrzywioną geometrię cząsteczkową w obecności tlenu, pokrewny związek heksafenylodisiloksan, Ph 3 Si–O–SiPh 3 , ma kąt Si–O–Si równy 180°.
Synteza
Synteza disiloksanu jest zwykle przeprowadzana przez pobranie gatunku hydrosilanu z podstawnikową grupą opuszczającą i poddanie go reakcji z wodą w celu wytworzenia silanolu. Silanol poddaje się następnie reakcji ze sobą, aby wytworzyć końcowy disiloksan poprzez sprzęganie odwadniające. Widać to w poniższych reakcjach:
H 3 SiX + H 2 O → H 3 SiOH + HX (pierwszy krok)
2 H 3 SiOH → H 3 SiOSiH 3 + H 2 O (drugi etap)
Inne metody syntezy obejmują zastosowanie złota na węglu jako katalizatora reakcji prowadzonej w wodzie oraz katalizowane przez InBr 3 utlenianie hydrosilanów.
Używa
Disiloksany mogą być stosowane jako szczeliwa w budownictwie, farbach, tuszach i powłokach, kosmetykach, płynach mechanicznych, zastosowaniach tekstylnych i powłokach papierowych.
Komercyjne wykorzystanie disiloksanu jest powszechne w kosmetykach. Jest powszechnie spotykany w produktach takich jak filtry przeciwsłoneczne, kremy nawilżające, lakiery do włosów, kredki do oczu, spraye do ciała, lakiery do paznokci, płyny do demakijażu i odżywki. Właściwości, jakie wykazuje w tych produktach disiloksan, to m.in. szybkie schnięcie, redukcja przetłuszczania, nawilżanie, kondycjonowanie skóry i działanie przeciwpieniące (zapobiegające tworzeniu się piany).
Disiloksany zostały zatwierdzone jako bezpieczne dla nastolatków i dzieci. Stwierdzono, że różnego rodzaju siloksany są wyjątkowo bezpieczne do stosowania miejscowego, ale mogą być niebezpieczne w przypadku spożycia w dużych ilościach.
Wariacje
Termin disiloksan jest powszechnie używany w odniesieniu do struktur, które wykazują znacznie bardziej złożone grupy R niż wodór. Najczęstszą cząsteczką wykorzystującą to nazewnictwo jest heksametylodisiloksan , który zastępuje grupy wodorowe grupami metylowymi. Inne powszechne odmiany obejmują stosowanie disiloksanów jako mostków i przekładek w większych związkach, takich jak polimery.
- Sawama, Y.; Masuda, M.; Yasukawa, N.; Nakatani, R.; Nishimura, S.; Shibata, K.; Yamada, T.; Monguchi, Y.; Suzuka, H.; Takagi, Y.; Sajiki, H. The Journal of Organic Chemistry 2016, 81 , 4190–4195.
- Disiloxane https://pubchem.ncbi.nlm.nih.gov/compound/Disiloxane (dostęp 23 marca 2018).
- Lassen, C.; Hansen, C.; Mikkelsen S.; Maag, J. Siloxanes-Consumption, Toxicity, and Alternatives ; Duńskie Ministerstwo Środowiska, 2018.
- Panie, R.; Robinson, D.; Schumb, W. Journal of the American Chemical Society 1956, 78 , 1327-1332.
- Varma R.; MacDiarmid, A.; Miller, J. Chemia nieorganiczna 1964, 3 , 1754–1757.
- BOCK, H.; MOLLERE, P.; BECKER, G.; FRITZ, G. Chemischer Informationsdienst 1974, 5 , 113-125.
- Disiloksan | H6OSi2 | ChemSpider http://www.chemspider.com/Chemical-Structure.109921.html (dostęp 23 marca 2018).
