Azotan niklu(II).
|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Azotan niklu(II).
|
|
| Inne nazwy Azotan niklu Azotan niklu Kwas azotowy, sól niklu(2+). |
|
| Identyfikatory | |
|
|
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.032.774 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII |
|
| Numer ONZ | 2725 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| Ni(NO 3 ) 2 | |
| Masa cząsteczkowa |
182,703 g/mol (bezwodny) 290,79 g/mol (heksahydrat) |
| Wygląd | szmaragdowozielone higroskopijne ciało stałe |
| Zapach | bezwonny |
| Gęstość | 2,05 g/cm 3 (heksahydrat) |
| Temperatura topnienia | 56,7 ° C (134,1 ° F; 329,8 K) (heksahydrat) |
| Temperatura wrzenia | 136,7 ° C (278,1 ° F; 409,8 K) (heksahydrat) |
| 243 (heksahydrat) g/100 ml (0 °C) | |
| Rozpuszczalność | rozpuszczalny w etanolu |
| +4300,0·10 −6 cm 3 /mol (+6 H 2 O) | |
|
Współczynnik załamania światła ( n D )
|
1,422 (heksahydrat) |
| Struktura | |
| jednoskośny (heksahydrat) | |
| Zagrożenia | |
| Oznakowanie GHS : | |
    
|
|
| Niebezpieczeństwo | |
| H272 , H302 , H315 , H317 , H318 , H332 , H334 , H341 , H350 , H360 , H372 , H410 | |
| P201 , P202 , P210 , P220 , P221 , P260 , P261 , P264 , P270 , P271 , P272 , P273 , P280 , P281 , P285 , P301+P312 , P302 +P352 , P304+P312 , P304+P340 , P304 + P341 , P305+P351+P338 , P308+P313 , P310 , P312 , P314 , P321 , P330 , P332+P313 , P333 +P313 , P342+P311 , P362 , P363 , P370+P378 , P391 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | Nie palne |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
1620 mg/kg (doustnie, szczur) |
| Karta charakterystyki (SDS) | Zewnętrzna karta charakterystyki |
| Związki pokrewne | |
|
Inne aniony
|
Siarczan niklu(II) Chlorek niklu(II). |
|
Inne kationy
|
Azotan palladu(II). |
|
Związki pokrewne
|
kobaltu(II) Azotan miedzi(II). |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
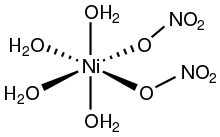
Azotan niklu to związek nieorganiczny Ni(NO 3 ) 2 lub dowolny jego hydrat . Postać bezwodna nie jest powszechnie spotykana, dlatego „azotan niklu” zwykle odnosi się do heksahydratu azotanu niklu (II) . Wzór na ten gatunek można zapisać na dwa sposoby: Ni(NO 3 ) 2 . 6H 2 O i bardziej opisowo [Ni(H 2 O) 6 ](NO 3 ) 2 . Ten ostatni wzór wskazuje, że niklu (II) jest otoczone sześcioma cząsteczkami wody w tej uwodnionej soli. W heksahydracie azotanowe nie są związane z niklem. Znane są również trzy inne hydraty: Ni(NO 3 ) 2 . 9H2O , Ni ( NO3 ) 2 . 4H2O i Ni ( NO3 ) 2 . 2H 2 O. Bezwodny Ni(NO 3 ) 2 jest również znany.
Otrzymuje się go w reakcji tlenku niklu z kwasem azotowym:
- NiO + 2 HNO 3 + 5 H 2 O → Ni(NO 3 ) 2 . 6H2O _ _
Bezwodnego azotanu niklu zazwyczaj nie wytwarza się przez ogrzewanie hydratów. Powstaje raczej w wyniku reakcji hydratów z pięciotlenkiem diazotu lub karbonylku niklu z tetratlenkiem diazotu :
- Ni(CO) 4 + 2 N 2 O 4 → Ni(NO 3 ) 2 + 2 NO + 4 CO
Uwodniony azotan jest często używany jako prekursor katalizatorów niklowych na nośniku .
Struktura
Związki niklu (II) z utlenionymi ligandami często mają oktaedryczną geometrię koordynacyjną. Dwa polimorfy tetrahydratu Ni(NO 3 ) 2 . 4H2O wykrystalizowały . W jednym jednokleszczowe ligandy azotanowe są trans, podczas gdy w drugim są cis.
Bezpieczeństwo
Podobnie jak inne azotany, azotan niklu jest utleniaczem . Działa również drażniąco na oczy, skórę, aw przypadku wdychania pyłu na drogi oddechowe . Może powodować alergię skórną . Azotan niklu jest czynnikiem rakotwórczym , podobnie jak większość innych związków niklu. Jon niklu jest również toksyczny dla organizmów wodnych.
Używa
Azotan niklu (II) jest używany głównie do galwanizacji i galwanizacji metalicznego niklu.
