Domena C2
| Domena C2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Domena C2 α-toksyny C.absonum (PDB 1OLP). Nici β są pokazane na żółto, α-helisy na czerwono, pętle na zielono. Skoordynowane wapnia są w kolorze cyjanowym.
| |||||||||
| Identyfikatory | |||||||||
| Symbol | C2 | ||||||||
| Pfam | PF00168 | ||||||||
| InterPro | IPR000008 | ||||||||
| MĄDRY | C2 | ||||||||
| PROZYTA | PDOC00380 | ||||||||
| SCOP2 | 1qas / ZAKRES / SUPFAM | ||||||||
| Nadrodzina OPM | 45 | ||||||||
| Białko OPM | 1ugk | ||||||||
| CDD | cd00030 | ||||||||
| |||||||||
| 3-kinaza fosfoinozytydu C2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
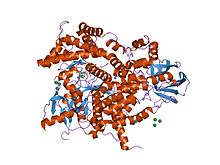 Struktura 3-kinazy fosfoinozytydu.
| |||||||||||
| Identyfikatory | |||||||||||
| Symbol | PI3K_C2 | ||||||||||
| Pfam | PF00792 | ||||||||||
| InterPro | IPR002420 | ||||||||||
| MĄDRY | PI3K_C2 | ||||||||||
| PROZYTA | PDOC50004 | ||||||||||
| SCOP2 | 1e8x / ZAKRES / SUPFAM | ||||||||||
| CDD | cd08380 | ||||||||||
| |||||||||||
Domena C2 jest domeną strukturalną białka zaangażowaną w kierowanie białek do błon komórkowych . Typowa wersja (PKC-C2) ma kanapkę beta złożoną z 8 nici β , które koordynują dwa lub trzy jony wapnia , które wiążą się we wnęce utworzonej przez pierwszą i ostatnią pętlę domeny, na powierzchni wiążącej błonę . Wiele innych rodzin domen C2 nie ma aktywności wiązania wapnia.
Łączenie z innymi domenami
Domeny C2 są często spotykane jako sprzężone z domenami enzymatycznymi ; na przykład domena C2 w PTEN , doprowadza domenę fosfatazy do kontaktu z błoną plazmatyczną, gdzie może defosforylować swój substrat, fosfatydyloinozytol (3,4,5)-trisfosforan (PIP 3 ) , bez usuwania go z błony - co byłby bardzo kosztowny energetycznie. PTEN składa się z dwóch domen, białkowej fosfatazy tyrozynowej i domeny C2. Ta para domen stanowi superdomenę, dziedziczną jednostkę występującą w różnych białkach grzybów, roślin i zwierząt. Ponadto 3-kinaza fosfatydyloinozytolu (kinaza PI3), enzym, który fosforyluje fosfoinozytydy na grupie 3-hydroksylowej pierścienia inozytolu , również wykorzystuje domenę C2 do wiązania się z błoną (np. wpis 1e8w PDB).
Ewolucja
Domena C2 jest obecnie znana tylko z eukariontów i prokariotów Clostridium perfringens , gdzie jest częścią toksyny alfa . Zidentyfikowano ponad 17 różnych kladów domen C2. Większość rodzin C2 można prześledzić wstecz do podstawowych gatunków eukariotycznych, co wskazuje na wczesne zróżnicowanie przed ostatnim wspólnym przodkiem eukariotycznym (LECA). Tylko rodzina domen PKC-C2 zawiera konserwatywne reszty wiążące wapń, co sugeruje, że typowa zależna od wapnia interakcja błonowa jest cechą pochodną ograniczoną do domen PKC-C2.
Selektywność wapnia i lipidów
Domeny C2 są unikalne wśród domen kierujących do błony, ponieważ wykazują szeroki zakres selektywności lipidów dla głównych składników błon komórkowych, w tym fosfatydyloseryny i fosfatydylocholiny. Ta domena C2 ma około 116 reszt aminokwasowych i jest zlokalizowana pomiędzy dwiema kopiami domeny C1 w Kinazie Białkowej C (która wiąże estry forbolu i diacyloglicerol) (patrz PDOC00379) i domenę katalityczną kinazy białkowej (patrz PDOC00100 ). W wielu białkach znaleziono regiony o znacznej homologii z domeną C2. Uważa się, że domena C2 bierze udział w zależnym od wapnia wiązaniu fosfolipidów oraz w procesach kierowania do błony, takich jak lokalizacja subkomórkowa. Chociaż większość domen C2 oddziałuje z błoną (fosfolipidami) w sposób zależny od Ca2 + , niektóre domeny C2 mogą oddziaływać z błoną bez wiązania się z Ca2 + . Podobnie, domeny C2 zostały wyewoluowane, aby mieć różne specyficzności dla lipidów. Wiele domen C2, takich jak synaptotagmina C2A, wiąże się z fosfolipidami anionowymi (fosfolipidy zawierające PS lub PIP2). Jednak inne domeny C2, takie jak domena cPLA2-α C2, wiążą się z lipidami obojnaczymi (np. PC). Ta różnorodność i selektywność w wiązaniu Ca2 + i lipidów sugeruje, że domeny C2 wyewoluowały, aby pełnić różne funkcje.
Struktura 3D
Domena tworzy ośmioniciową kanapkę beta zbudowaną wokół konserwatywnego 4-niciowego motywu, oznaczonego jako klucz C2. Wapń wiąże się w miseczkowatym zagłębieniu utworzonym przez N- i C-końcowe pętle motywu klucza C2. Analizy strukturalne kilku domen C2 wykazały, że składają się one z podobnych trójskładnikowych struktur, w których trzy pętle wiążące Ca2 + znajdują się na końcu 8-niciowej antyrównoległej kanapki beta.
Białka ludzkie zawierające domenę C2
ABR; BAIAP3 ; BCR ; C2CD2; C2CD3; CADPS ; CADPS2 ; CAPN5 ; CAPN6 ; CC2D1A ; CC2D1B; CPNE1 ; CPNE2; CPNE3; CPNE4 ; CPNE5; CPNE6 ; CPNE7 ; CPNE8 ; CPNE9; DAB2IP ; DOC2A ; DOC2B ; DYSF ; ESYT1 ; ESYT3; FAM62A ; FAM62B ; FAM62C; FER1L3 ; FER1L5; HECW1 ; HECW2 ; swędzenie ; ITSN1 ; ITSN2 ; MCTP1; MCTP2; MTAC2D1; NEDD4 ; NEDD4L ; NEDL1; OTOF ; PCLO ; PIK3C2A ; PIK3C2B ; PIK3C2G ; PLA2G4A ; PLA2G4B ; PLA2G4D; PLA2G4E; PLA2G4F; PLCB1 ; PLCB2 ; PLCB3 ; PLCB4 ; PLCD1 ; PLCD3 ; PLCD4 ; PLCE1 ; PLCG1 ; PLCG2 ; PLCH1; PLCH2; PLCL1; PLCL2; PLCZ1; PRF1 ; PRKCA ; PRKCB1 ; PRKCE ; PRKCG ; PRKCH ; RAB11FIP1 ; RAB11FIP2 ; RAB11FIP5 ; RASA1 ; RASA2; RASA3 ; RASA4 ; RASAL1; RASAL2 ; RGS3 ; FELGI1 ; FELGI2 ; FELGI 3; FELGI4; RPGRIP1 ; RPGRIP1L ; RPH3A ; SGA72M; SMURF1 ; SMURF2 ; SYNGAP1 ; SYT1 ; SYT10; SYT11 ; SYT12; SYT13 ; SYT14 ; SYT14L; SYT15; SYT16; SYT17; SYT2 ; SYT3 ; SYT4 ; SYT5 ; SYT6 ; SYT7 ; SYT8; SYT9 ; SYTL1 ; SYTL2 ; SYTL3; SYTL4 ; SYTL5; TOLLIP ; UNC13A ; UNC13B ; UNC13C; UNC13D ; WWC 2 ; WWP1 ; WWP2 ; PTEN
Linki zewnętrzne
- Rodzina fosfoinozytydów 3-kinazy C2 w Pfam
- UMich Orientacja białek w rodzinach błon/nadrodzina-47 - Orientacje domen C2 w błonach (OPM)