Całkowita synteza oseltamiwiru
Całkowita synteza oseltamiwiru dotyczy całkowitej syntezy leku przeciwgrypowego oseltamiwiru sprzedawanego przez firmę Hoffmann-La Roche pod nazwą handlową Tamiflu . Jego komercyjna produkcja zaczyna się od biomolekuły kwasu szikimowego zbieranego z chińskiego anyżu gwiaździstego i rekombinowanej E. coli . Ważna jest kontrola stereochemii: cząsteczka ma trzy stereocentra , a poszukiwanym izomerem jest tylko 1 z 8 stereoizomerów. [ potrzebne źródło ]
Produkcja komercyjna
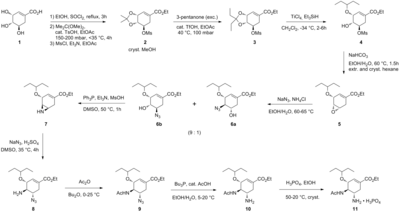
Obecna metoda produkcji opiera się na pierwszej skalowalnej syntezie opracowanej przez Gilead Sciences , wychodzącej z naturalnie występującego kwasu chinowego lub kwasu szikimowego . Ze względu na niższe wydajności i wymagane dodatkowe etapy (ze względu na dodatkowe odwodnienie), droga kwasu chinowego została odrzucona na rzecz tej opartej na kwasie szikimowym, która została dodatkowo ulepszona przez firmę Hoffmann-La Roche . Obecna synteza przemysłowa jest podsumowana poniżej:
Synteza Karpfa/Trussardiego
Obecna metoda produkcji obejmuje dwa etapy reakcji z potencjalnie niebezpiecznymi azydkami . Zgłoszona bezazydkowa synteza tamiflu firmy Roche została podsumowana graficznie poniżej:
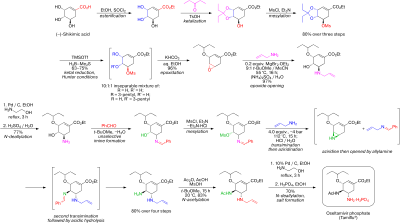
Syntezę rozpoczyna się od naturalnie dostępnego kwasu (-)-szikimowego . Mesylan acetalu 3,4-pentylidenu wytwarza się w trzech etapach: estryfikacja etanolem i chlorkiem tionylu ; ketalizacja kwasem p -toluenosulfonowym i 3-pentanonem ; i mesylowanie trietyloaminą i chlorkiem metanosulfonylu . Redukcyjne otwarcie ketalu w zmodyfikowanych warunkach Huntera w dichlorometanie daje nierozerwalną mieszaninę izomerycznych mesylanów. Odpowiedni epoksyd tworzy się w warunkach zasadowych z wodorowęglanem potasu . Używając niedrogiego kwasu Lewisa (zwykle przygotowywanego na świeżo przez dodanie wiórków magnezowych do 1,2-dibromoetanu w benzenie : eterze dietylowym ), epoksyd otwiera się alliloaminą, otrzymując odpowiedni 1,2-aminoalkohol. Rozpuszczalniki niemieszające się z wodą eter metylowo-tert-butylowy i acetonitryl są stosowane w celu uproszczenia procedury obróbki, która obejmowała mieszanie z 1 M wodnym roztworem siarczanu amonu . Redukcja na palladzie , wspomagana etanoloaminą , a następnie obróbka kwasem dała odbezpieczony 1,2-aminoalkohol. Aminoalkohol został przekształcony bezpośrednio w odpowiednią allilodiaminę w interesującej sekwencji kaskadowej, która rozpoczyna się od nieselektywnej iminacji benzaldehydu azeotropowym usuwanie wody w eterze metylowo-tert-butylowym. Mesylacja, po której następuje usunięcie stałego produktu ubocznego, chlorowodorku trietyloaminy , daje związek pośredni, który był gotowy do poddania się azyrydynacji po transiminacji innym równoważnikiem alliloaminy. Z librowanym kwasem metanosulfonowym azyrydyna otwiera się czysto, dając diaminę, która natychmiast przechodzi drugą transiminację . Kwaśna hydroliza następnie usuwa iminę . Selektywne acylowanie bezwodnikiem octowym (w warunkach zbuforowanych grupa 5-aminowa jest protonowana z powodu znacznej różnicy w p Ka, 4,2 vs 7,9, co zapobiega acetylacji ) daje pożądany N acetylowany - produkt w postaci krystalicznej po obróbce ekstrakcyjnej. Wreszcie, delilacja jak powyżej dała wolną zasadę oseltamiwiru, która została przekształcona w pożądany fosforan oseltamiwiru przez traktowanie kwasem fosforowym . Otrzymuje się produkt końcowy o wysokiej czystości (99,7%) i całkowitej wydajności 17-22% z kwasu (-)-szikimowego. Należy zauważyć, że w syntezie unika się stosowania potencjalnie wybuchowych azydkowych i związków pośrednich; jednak synteza faktycznie stosowana przez Roche wykorzystuje azydki. Roche ma inne drogi prowadzące do oseltamiwiru, które nie wymagają użycia kwasu (-)-szikimowego jako materiału wyjściowego puli chiralnej, takie jak droga Dielsa-Aldera obejmująca furan i akrylan etylu lub droga kwasu izoftalowego, która obejmuje uwodornienie katalityczne i enzymatyczne desymetryzacja. [ potrzebne źródło ]
Synteza Coreya
W 2006 roku grupa EJ Corey opublikowała nowatorską metodę omijania kwasu szikimowego, rozpoczynającą się od butadienu i kwasu akrylowego . Wynalazcy postanowili nie patentować tej procedury, która jest opisana poniżej.
Butadien 1 reaguje w asymetrycznej reakcji Dielsa-Aldera z produktem estryfikacji kwasu akrylowego i 2,2,2-trifluoroetanolu 2 katalizowanej katalizatorem CBS . Ester 3 jest przekształcany w amid w 4 w reakcji z amoniakiem , a następnym krokiem do laktamu 5 jest jodolaktamizacja jodem inicjowany triflatem trimetylosililu. Grupa amidowa jest dopasowywana do grupy zabezpieczającej BOC w reakcji z bezwodnikiem Boc w 6 , a podstawnik jodowy jest usuwany w reakcji eliminacji z DBU do alkenu 7 . Brom jest wprowadzany w 8 przez bromowanie allilowe NBS , a grupa amidowa jest odcinana etanolem i węglanem cezu , czemu towarzyszy eliminacja bromku do dienowego estru etylowego 9 . Nowo utworzone wiązanie podwójne jest funkcjonalizowane N -bromoacetamidem 10 katalizowanym bromkiem cyny(IV) z pełną kontrolą stereochemii . W kolejnym etapie atom bromu w 11 zostaje zastąpiony przez atom azotu w grupie amidowej z mocną zasadą KHMDS do azyrydyny 12 , która z kolei otwiera się w reakcji z 3-pentanolem 13 do eteru 14 . W ostatnim etapie usuwa się grupę BOC powstaje kwas fosforowy i fosforan oseltamiwiru 15 .
Synteza Shibasakiego
Również w 2006 roku grupa Masakatsu Shibasaki z Uniwersytetu Tokijskiego opublikowała syntezę ponownie z pominięciem kwasu szikimowego.
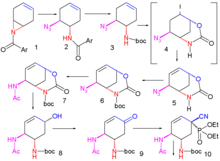
Ulepszona metoda opublikowana w 2007 r. zaczyna się od enancjoselektywnej desymetryzacji azyrydyny 1 za pomocą azydku trimetylosililu (TMSN 3 ) i chiralnego katalizatora do azydku 2 . Grupa amidowa jest zabezpieczona jako grupa BOC z bezwodnikiem Boc i DMAP w 3 , a jodolaktamizacja jodem i węglanem potasu daje najpierw niestabilny związek pośredni 4 następnie trwały cykliczny karbaminian 5 po wyeliminowaniu jodowodoru za pomocą DBU .
Grupa amidowa jest ponownie chroniona jako BOC 6 , a grupa azydkowa jest przekształcana w amid 7 przez redukujące acylowanie kwasem tiooctowym i 2,6-lutydyną . Węglan cezu powoduje hydrolizę grupy karbaminianowej do alkoholu 8 , który jest następnie utleniany do ketonu 9 za pomocą nadjodanu Dessa-Martina . Cyjanofosforylacja fosforocyjanianem dietylu (DEPC) modyfikuje grupę ketonową do cyjanofosforanu 10 torując drogę do wewnątrzcząsteczkowego przegrupowania allilowego do niestabilnego fosforanu β-allilu 11 (toluen, zamknięta probówka), który jest hydrolizowany do alkoholu 12 za pomocą chlorku amonu . Ta grupa hydroksylowa ma niewłaściwą stereochemię i dlatego jest odwracana w reakcji Mitsunobu z kwasem p-nitrobenzoesowym, po której następuje hydroliza p-nitrobenzoesanu do 13 .
Następnie druga reakcja Mitsunobu tworzy azyrydynę 14 dostępną do reakcji otwarcia pierścienia z 3-pentanolem katalizowanym trifluorkiem boru do eteru 15 . W ostatnim etapie grupa BOC jest usuwana (HCl) i do obiektywu 16 dodawany jest kwas fosforowy .
Synteza Fukuyamy
Podejście opublikowane w 2007 roku, podobnie jak Corey, zaczyna się od asymetrycznej reakcji Dielsa-Aldera, tym razem z materiałami wyjściowymi, pirydyną i akroleiną .
Pirydynę ( 1 ) redukuje się borowodorkiem sodu w obecności chloromrówczanu benzylu do dihydropirydyny 2 zabezpieczonej Cbz . Asymetryczna reakcja Dielsa-Aldera z akroleiną 3 jest prowadzona z katalizatorem McMillana do aldehydu 4 jako endo izomeru , który jest utleniany do kwasu karboksylowego 5 chlorynem sodu , fosforanem monopotasowym i 2-metylo-2-buten . Dodatek bromu daje produkt halolaktonizacji 6 i po zastąpieniu grupy zabezpieczającej Cbz grupą zabezpieczającą BOC w 7 ( hydroliza w obecności di- tert -butylodiwęglanu ) grupa karbonylowa jest wprowadzona do związku pośredniego 8 przez katalityczny tlenek rutenu(IV) oraz katalizator protektorowy nadjodan sodu . Dodatek amoniak rozszczepia grupę estrową, tworząc amid 9 , którego grupa alkoholowa jest mesylowana do związku 10 . W kolejnym etapie dioctan jodobenzenu , przekształcając amid w przegrupowaniu Hofmanna w karbaminian allilu 12 po wychwyceniu pośredniego izocyjanianu alkoholem allilowym 11 . Po dodaniu etanolanu sodu do etanolu zachodzą jednocześnie trzy reakcje: rozszczepienie amidu estru etylowego , podstawienie grupy mesylowej przez nowo utworzoną grupę aminową zabezpieczoną BOC do grupy azyrydynowej i reakcja eliminacji z utworzeniem grupy alkenowej w 13 z uwolnieniem HBr. W ostatnich dwóch etapach pierścień azyrydynowy jest otwierany przez 3-pentanol 14 i trifluorek boru do aminoeteru 15 z grupą BOC zastąpioną grupą acylową i po usunięciu drugiej grupy zabezpieczającej aminę ( Pd / C , Ph 3 P i kwas 1,3-dimetylobarbiturowy w etanolu) i otrzymuje się dodatek kwasu fosforowego oseltamivir 16 .
Synteza Trosta
W 2008 roku grupa Barry'ego M. Trosta z Uniwersytetu Stanforda opublikowała najkrótszą jak dotąd drogę syntezy.
Synteza Hayashiego
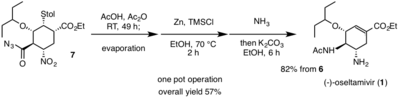
W 2009 roku Hayashi i in. z powodzeniem wyprodukowali wydajną, tanią drogę syntezy do przygotowania (-)-oseltamiwiru ( 1 ). Ich celem było zaprojektowanie procedury, która nadawałaby się do produkcji na dużą skalę. Pamiętając o kosztach, wydajności i liczbie etapów syntezy, enancjoselektywną całkowitą syntezę ( 1 ) przeprowadzono w trzech operacjach w jednym naczyniu. Wykorzystanie przez Hayashi i wsp. operacji w jednym naczyniu umożliwiło im wykonanie kilku etapów reakcji w jednym naczyniu, co ostatecznie zminimalizowało liczbę potrzebnych etapów oczyszczania, straty i zaoszczędziło czas.
W pierwszej operacji jednogarnkowej Hayashi i in. rozpoczyna się od zastosowania eteru sililowego difenyloprolinolu ( 4 ) jako organokatalizatora wraz z alkoksyaldehydem ( 2 ) i nitroalkenem ( 3 ) w celu przeprowadzenia asymetrycznej reakcji Michaela , w wyniku której powstaje enancjoselektywny addukt Michaela . Po dodaniu pochodnej fosforanu winylu dietylu ( 5 ) do adduktu Michaela , reakcja Michaela domina i Horner-Wadsworth-Emmons reakcja zachodzi z powodu grupy fosfonianowej wytwarzanej z ( 5 ), dając pochodną cykloheksenokarboksylanu etylu wraz z dwoma niepożądanymi produktami ubocznymi. W celu przekształcenia niepożądanych produktów ubocznych w pożądaną pochodną cykloheksenokarboksylanu etylu, mieszaninę produktu i produktów ubocznych potraktowano Cs2CO3 w etanolu. Wywołało to reakcję retro-Michaela na jednym produkcie ubocznym i reakcję retro-aldolową , której towarzyszyła reakcja Hornera-Wadswortha-Emmonsa na drugi. Oba produkty uboczne pomyślnie przekształcono w pożądaną pochodną. Na koniec dodanie str -toluenotiol z Cs2CO3 daje ( 6 ) z wydajnością 70% po oczyszczeniu metodą chromatografii kolumnowej , z przewagą żądanego izomeru .
W drugiej operacji w jednym naczyniu kwas trifluorooctowy stosuje się najpierw do odbezpieczenia estru tert -butylowego związku ( 6 ); wszelki nadmiar odczynnika usunięto przez odparowanie. Kwas karboksylowy wytworzony w wyniku odbezpieczenia został następnie przekształcony w chlorek acylu przez chlorek oksalilu i katalityczną ilość DMF . Wreszcie dodanie azydku sodu w ostatniej reakcji drugiej operacji w jednym naczyniu daje azydek acylu ( 7 ) bez potrzeby jakiegokolwiek oczyszczania.
Końcowa operacja w jednym naczyniu rozpoczyna się od przegrupowania Curtiusa azydku acylu ( 7 ) w celu wytworzenia izocyjanianowej grupy funkcyjnej w temperaturze pokojowej. Pochodna izocyjanianowa reaguje następnie z kwasem octowym , dając pożądane ugrupowanie acetyloaminowe znalezione w ( 1 ). To przegrupowanie domina Curtiusa i tworzenie amidu zachodzi przy braku ciepła, co jest niezwykle korzystne dla zmniejszenia wszelkiego możliwego zagrożenia. Ugrupowanie nitrowe ( 7 ) jest redukowane do pożądanej aminy obserwowanej w ( 1 ) z Zn/HCl. Ze względu na trudne warunki redukcji nitrowej do zobojętnienia reakcji użyto amoniaku. węglan potasu, otrzymując ( 1 ), poprzez retro-Michaelową reakcję tiolu . ( 1 ) następnie oczyszczono przez ekstrakcję kwasem/zasadą. Całkowita wydajność całkowitej syntezy (-)-oseltamiwiru wynosi 57%. Hayashi i in. zastosowanie niedrogich, bezpiecznych odczynników pozwoliło na opracowanie wydajnej, wysokowydajnej drogi syntezy, która może pozwolić na wytworzenie ogromnej ilości nowych pochodnych w nadziei na zwalczanie wirusów opornych na (-)-oseltamiwir.