Dimetyloglioksym

|
|
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
N , N′ -dihydroksy-2,3-butanodiimina
|
|
Inne nazwy
|
|
| Identyfikatory | |
|
|
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.002.201 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| Numer RTECS |
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C4H8N2O2 _ _ _ _ _ _ _ | |
| Masa cząsteczkowa | 116,120 g·mol -1 |
| Wygląd | Biały/biały proszek |
| Gęstość | 1,37 g/cm 3 |
| Temperatura topnienia | 240 do 241 ° C (464 do 466 ° F; 513 do 514 K) |
| Temperatura wrzenia | rozkłada się |
| Niski | |
| Struktura | |
| 0 | |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Toksyczny, drażniący skórę/oczy |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H228 , H301 | |
| P210 , P240 , P241 , P264 , P270 , P280 , P301+P310 , P321 , P330 , P370+P378 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Karta charakterystyki (SDS) | Zewnętrzna karta charakterystyki |
| Związki pokrewne | |
|
Związki pokrewne
|
salicylaldoksym hydroksyloaminy |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
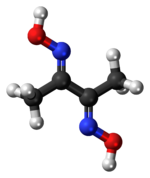
Dimetyloglioksym jest związkiem chemicznym opisanym wzorem CH 3 C(NOH)C(NOH)CH 3 . Jego skrót to dmgH 2 dla formy obojętnej, a dmgH − dla formy anionowej, gdzie H oznacza wodór. To bezbarwne ciało stałe jest dioksymową pochodną diketonu butano -2,3-dionu (znanego również jako diacetyl ). DmgH 2 jest stosowany w analizie palladu lub niklu . Jego kompleksy koordynacyjne mają teoretyczne znaczenie jako modele enzymów i katalizatory. Wiele pokrewnych ligandów można wytworzyć z innych diketonów, np. benzylu .
Przygotowanie
Dimetyloglioksym można najpierw wytworzyć z butanonu w reakcji z azotynem etylu, z wytworzeniem monooksymu biacetylu . Drugi oksym jest instalowany przy użyciu monosulfonianu hydroksyloaminy sodu :
Kompleksy
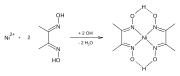
Dimetyloglioksym tworzy kompleksy z metalami, w tym z niklem , palladem i kobaltem . Kompleksy te wykorzystywane są do oddzielania tych kationów z roztworów soli metali oraz w analizie grawimetrycznej . Jest również stosowany w rafinacji metali szlachetnych do wytrącania palladu z roztworów chlorku palladu .
Reakcja tworzenia Ni-dmg
Próbka Ni(dmgH) 2