dwunastościan

|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
nazwy IUPAC
(C 20 - I h )[5]fulleran heksadekahydro-1,6,5,2,4,3-(epibutan[1,1,2,3,4,4]heksailo)dipentaleno[2,1,6- gha :2′,1′,6′- cde ]pentalen |
|||
|
Systematyczna nazwa IUPAC
undekacyklo [ 9,9,0,0 2,9,0 3,7,0 4,20,0 5,18,0 6,16,0 8,15,0 10,14,0 12,19,0 13,17 ] ikosan _ _ _ _ _ |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CHEBI | |||
| ChemSpider | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 20 H 20 | |||
| Masa cząsteczkowa | 260,380 g·mol -1 | ||
| Temperatura topnienia | 430±10°C | ||
| Związki pokrewne | |||
|
Powiązane węglowodory
|
Cubane Tetrahedrane Pagodane (izomer dwunastościanu) Prismane |
||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
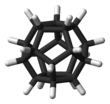
Dwunastościan jest związkiem chemicznym , węglowodorem o wzorze C 20 H 20 , którego atomy węgla ułożone są w wierzchołki (narożniki) dwunastościanu foremnego . Każdy atom węgla jest związany z trzema sąsiednimi atomami węgla i atomem wodoru . Związek ten jest jednym z trzech możliwych węglowodorów platońskich , pozostałe dwa to kuban i czworościan .
Dodekaedran nie występuje w przyrodzie i nie ma znaczących zastosowań. Został zsyntetyzowany przez Leo Paquette w 1982 roku, głównie ze względu na „estetyczną symetrię dwunastościennego szkieletu”.
cząsteczką węglową o pełnej symetrii dwudziestościennej . Buckminsterfulleren ( C 60 ), odkryty w 1985 r., również ma taką samą symetrię, ale ma trzy razy więcej atomów węgla i ogólnie o 50% więcej atomów. Synteza C 20 fullerenu C 20 w 2000 r. z bromowanego dwunastościanu mogła zdegradować C 20 H 20 na drugie miejsce.
Struktura
Kąt między wiązaniami CC w każdym atomie węgla wynosi 108°, co jest kątem między sąsiednimi bokami pięciokąta foremnego . Ta wartość jest dość zbliżona do 109,5° kąta środkowego czworościanu foremnego — idealnego kąta między wiązaniami na atomie, który ma hybrydyzację (sp 3 . W rezultacie występuje minimalne odkształcenie kątowe . Jednak cząsteczka ma znaczny poziom odkształcenie skrętne w wyniku zaćmionej konformacji wzdłuż każdej krawędzi konstrukcji.
Cząsteczka ma idealną dwudziestościenną symetrię ( Ih ) , o czym świadczy jej protonowe widmo NMR, w którym wszystkie atomy wodoru pojawiają się z pojedynczym przesunięciem chemicznym wynoszącym 3,38 ppm. W przeciwieństwie do buckminsterfullerenu, dodekaedran nie ma zdelokalizowanych elektronów , a zatem nie ma aromatyczności .
Historia
Przez ponad 30 lat kilka grup badawczych aktywnie dążyło do całkowitej syntezy dodekaedranu. W artykule przeglądowym opublikowanym w 1978 roku opisano różne strategie, które istniały do tego czasu. Pierwsza próba została zapoczątkowana w 1964 roku przez RB Woodwarda od syntezy związku trichinacenu , o którym sądzono, że może po prostu dimeryzować do dwunastościanu. W wyścigu brały udział również inne grupy, na przykład Philip Eaton i Paul von Ragué Schleyer .
Grupa Leo Paquette z Ohio State University jako pierwsza odniosła sukces, wykonując złożoną 29-etapową trasę, która w większości buduje dwunastościenny szkielet po jednym pierścieniu na raz i ostatecznie zamyka ostatnią dziurę.
grupa Horsta Prinzbacha odkryła bardziej wszechstronną alternatywną drogę syntezy . Ich podejście opierało się na pagodanie izomeryzacji , otrzymanym z izodryny jako materiału wyjściowego m.in. poprzez fotocyklodycję [6+6] . Schleyer zastosował podobne podejście w swojej syntezie adamantanu .
Idąc za tym pomysłem, wspólne wysiłki zespołu Prinzbach i grupy Schleyer powiodły się, ale w najlepszym przypadku uzyskano tylko 8% wydajności konwersji. W następnej dekadzie grupa znacznie zoptymalizowała tę drogę, tak że dodekaedran można było otrzymać w ilościach wielogramowych. Nowa droga ułatwiła także otrzymywanie pochodnych z wybranymi podstawieniami i nienasyconymi wiązaniami węgiel-węgiel . Dwoma fulerenów C20 znaczącymi wydarzeniami było odkrycie σ-bishomoaromatyczności i tworzenie z silnie bromowanych gatunków dwunastościanów.
Synteza
Oryginalna trasa
Synteza organiczna Paquette z 1982 roku obejmuje około 29 etapów z surowcami cyklopentadien (2 równoważniki 10 atomów węgla), acetylenodikarboksylan dimetylu (4 atomy węgla) i allilotrimetylosilan (2 równoważniki, 6 atomów węgla).
W pierwszym etapie procedury dwie cząsteczki cyklopentadienu 1 są sprzęgane ze sobą w reakcji z pierwiastkowym sodem (tworząc kompleks cyklopentadienylu ) i jodem do dihydrofulwalenu 2 . Następna jest tandemowa reakcja Dielsa-Aldera z acetylenodikarboksylanem dimetylu 3 z pożądaną sekwencją pentadien-acetylen-pentadien jak w symetrycznym addukcie 4 . Tworzy się i odrzuca taką samą ilość asymetrycznego związku pentadien-pentadien-acetylen ( 4b ).
W następnym etapie sekwencji jod jest tymczasowo wprowadzany przez jodolaktonizację dikwasu 4 do dilaktonu 5 . Grupa estrowa jest następnie rozszczepiana przez metanol do halohydryny 6 , grupy alkoholowe przekształcane w grupy ketonowe w 7 przez utlenianie Jonesa , a grupy jodowe redukowane przez parę cynk-miedź w 8 .
Końcowe 6 atomów węgla jest wstawianych w addycji nukleofilowej do grup ketonowych karboanionu 10 generowanego z allilotrimetylosilanu 9 i n -butylolitu . W kolejnym etapie winylosilan 11 reaguje z kwasem nadoctowym w kwasie octowym w postaci podstawienia rodnikowego do dilaktonu 12 , po czym następuje wewnątrzcząsteczkowe alkilowanie Friedela-Craftsa pięciotlenkiem fosforu do diketonu 13 . Cząsteczka ta zawiera wszystkie wymagane 20 atomów węgla, a ponadto jest symetryczna, co ułatwia budowę pozostałych 5 wiązań węgiel-węgiel .
Redukcję wiązań podwójnych w pozycjach 13 do 14 przeprowadza się przez uwodornienie palladem na węglu , a grup ketonowych do grup alkoholowych w pozycji 15 borowodorkiem sodu . Zastąpienie grupy hydroksylowej chlorem w 17 poprzez nukleofilowe podstawienie alifatyczne odbywa się przez dilakton 16 ( chlorek tosylu ). Pierwsza reakcja tworzenia wiązań C-C jest rodzajem alkilowania brzozy ( lit , amoniak ) z natychmiastowym produktem reakcji uwięzionym przez eter chlorometylowo-fenylowy, drugi atom chloru w 17 jest po prostu redukowany. Ten tymczasowy dodatek zapobiegnie na późniejszym etapie niechcianej enolizacji . Nowo utworzona ketonowa tworzy następnie kolejne wiązanie C-C w fotochemicznej reakcji Norrish'a z 19 , którego grupa alkoholowa jest indukowana w celu wyeliminowania z TsOH do alkenu 20 .
Wiązanie podwójne jest redukowane za pomocą hydrazyny i kolejnej redukcji wodorkiem diizobutyloglinu , a utlenianie chlorochromianem pirydyny 21 tworzy aldehyd 22 . Następnie druga reakcja Norrish'a dodaje kolejne wiązanie C-C do alkoholu 23 i spełniwszy swoje zadanie, ogon fenoksy jest usuwany w kilku etapach: redukcja brzozy do diolu 24 , utlenianie chlorochromianem pirydyniowym do ketoaldehydu 25 i odwrotna kondensacja Claisena do ketonu 26 . Trzecia reakcja Norrish'a daje alkohol 27 , druga dehydratacja 28 i kolejna redukcja 29 , w którym to momencie synteza zostaje całkowicie pozbawiona grup funkcyjnych . Brakujące wiązanie CC jest wprowadzane na miejsce przez odwodornienie pod ciśnieniem wodoru z palladem na węglu w temperaturze 250 ° C do dwunastościanu 30 .
Trasa Pagoda
W zoptymalizowanej przez Prinzbacha drodze od pagodanu do dodekaedranu, pierwotna nisko wydajna izomeryzacja macierzystego pagodanu do dodekaedranu zostaje zastąpiona dłuższą, ale wydajniejszą sekwencją - która jednak nadal w dużym stopniu opiera się na pochodnych pagodanu. Na poniższym schemacie rozbieżność z oryginałem następuje po złożeniu 16.
Pochodne
Zsyntetyzowano i opisano w literaturze różne pochodne dodekaedranu.
Zastąpienie wodoru
Zastąpienie wszystkich 20 atomów wodoru atomami fluoru daje stosunkowo nietrwały perfluorododekaedran C 20 F 20 , który otrzymano w miligramowych ilościach. Śladowe ilości analogicznego nadchlorododekaedranu C 20 Cl 20 otrzymano, między innymi częściowo chlorowanymi pochodnymi, w reakcji C 20 H 20 rozpuszczonej w ciekłym chlorze pod ciśnieniem w temperaturze około 140 °C i przy intensywnym świetle przez pięć dni. Całkowite zastąpienie cięższymi halogenami wydaje się coraz trudniejsze ze względu na ich większe rozmiary. Połowę lub więcej atomów wodoru można zastąpić hydroksylowymi , aby uzyskać poliole , ale ekstremalny związek C 20 (OH) 20 pozostawał nieuchwytny od 2006 r. Przygotowano amino-dodekaedryny porównywalne z amantadyną , ale były bardziej toksyczne i słabsze działanie przeciwwirusowe.
Zaproponowano pierścieniowe struktury dwunastościanów.
Kapsułkowanie
Cząsteczki, których szkielet tworzy zamkniętą klatkę, takie jak dwunastościan i buckminsterfulleren, mogą zamykać atomy i małe cząsteczki w pustej przestrzeni wewnątrz. Te wstawki nie są chemicznie związane z materiałem klatki, ale jedynie mechanicznie w nim uwięzione.
Crossowi, Saundersowi i Prinzbachowi udało się zamknąć atomy helu w dwunastościanie, strzelając jonami He + do błony związku. Otrzymali mikrogramowe ilości He@ C 20 H 20 ("@" to standardowa notacja kapsułkowania), którą opisali jako całkiem stabilną substancję. Cząsteczka została opisana jako „najmniejszy na świecie balon wypełniony helem ”.