Heksakarbonyl wolframu

|
|
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Heksakarbonylwolfram
|
|
| Inne nazwy Wolfram karbonyl Heksakarbonylwolfram |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| Karta informacyjna ECHA | 100.034.423 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 6 O 6 W | |
| Masa cząsteczkowa | 351,901 g/mol |
| Wygląd | Bezbarwne ciało stałe |
| Gęstość | 2,65 g/cm 3 |
| Temperatura topnienia | 170 ° C (338 ° F; 443 K) (rozkłada się) |
| nierozpuszczalny | |
| Rozpuszczalność | oszczędnie w THF |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Produkt łatwopalny, źródło CO |
| Zagrożenia | |
| NFPA 704 (ognisty diament) | |
| Karta charakterystyki (SDS) | Karta charakterystyki zewnętrznej |
| Związki pokrewne | |
|
Inne kationy
|
Heksakarbonyl chromu Heksakarbonyl molibdenu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
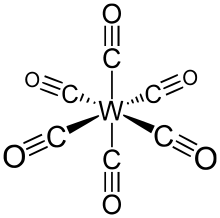
Heksakarbonylek wolframu (zwany także karbonylem wolframu ) to związek chemiczny o wzorze W(CO) 6 . Kompleks ten dał początek pierwszemu przykładowi kompleksu diwodorowego.
Ten bezbarwny związek, podobnie jak jego analogi chromu i molibdenu , jest godny uwagi jako lotna, stabilna w powietrzu pochodna wolframu na zerowym stopniu utlenienia.
Przygotowanie, właściwości i struktura
W(CO) 6 otrzymuje się przez redukcję sześciochlorku wolframu pod ciśnieniem tlenku węgla . Związek jest względnie stabilny w powietrzu. Jest trudno rozpuszczalny w niepolarnych rozpuszczalnikach organicznych. Karbonylek wolframu jest szeroko stosowany w osadzania indukowanego wiązką elektronów - jest łatwo odparowywany i rozkładany przez wiązkę elektronów, zapewniając wygodne źródło atomów wolframu.
0 W(CO) 6 przyjmuje geometrię oktaedryczną składającą się z sześciu podobnych do prętów ligandów CO promieniujących z centralnego atomu W z momentem dipolowym D .
Reaktywność
Wszystkie reakcje W(CO) 6 rozpoczynają się od wyparcia niektórych ligandów CO w W(CO) 6 . W(CO) 6 zachowuje się podobnie do Mo(CO) 6 , ale ma tendencję do tworzenia związków o większej wytrzymałości kinetycznej.
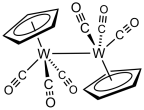
Traktowanie heksakarbonylu wolframu cyklopentadienidem sodu, a następnie utlenianie otrzymanego NaW(CO) 3 (C5H5 ) daje dimer trikarbonylu cyklopentadienylotungstenu .
Jedną z pochodnych jest kompleks diwodorowy W(CO) 3 [P(C 6 H 11 ) 3 ] 2 (H 2 ).
Trzy z tych ligandów CO można zastąpić acetonitrylem. W(CO) 6 był używany do odsiarczania związków siarkoorganicznych i jako prekursor katalizatorów metatezy alkenów .
Bezpieczeństwo i obsługa
Podobnie jak wszystkie karbonylki metali, W(CO) 6 jest niebezpiecznym źródłem lotnych metali, jak również CO.
- ^ Nawet J.; Jakuszew, A.; Dullmann, CE; Haba, H.; Asai, M.; Sato, TK; Marka, H.; Di Nitto, A.; Eichler, R.; Wentylator, Floryda; Hartmann, W.; Huang, M.; Jager, E.; Kaji, D.; Kanaya, J.; Kaneya, Y.; Khuyagbaatar, J.; Kindler, B.; Kratz, JV; Krier, J.; Kudou, Y.; Kurz N.; Lommel, B.; Miyashita, S.; Morimoto, K.; Morita, K.; Murakami, M.; Nagame, Y.; Nitsche, H.; i in. (2014). „Synteza i wykrywanie kompleksu karbonylu seaborgium”. nauka . 345 (6203): 1491-3. Bibcode : 2014Sci...345.1491E . doi : 10.1126/nauka.1255720 . PMID 25237098 . S2CID 206558746 . (wymagana subskrypcja)
- ^ a b Kubas, GJ, Metal Dihydrogen and σ-Bond Complexes, Kluwer Academic/Plenum Publishers: New York, 2001.
- Bibliografia _ Fowlkes, J.; Stojak, P. (2006). „Skoncentrowane osadzanie i trawienie indukowane wiązką elektronów w nanoskali”. Krytyczne recenzje nauki o ciele stałym i materiałach . 31 (3): 55. Bibcode : 2006CRSSM..31...55R . doi : 10.1080/10408430600930438 . S2CID 93769658 .
- Bibliografia _ Hacket, Paweł; Birdwhistell, Ralph (1990). "Heksakarbonylobis(η 5 -cyklopentadienylo)dichrom, molibden i wolfram oraz ich analogi, M 2 (η 5 -C 5 H 4 R) 2 (CO) 6 (M = Cr, Mo i W; R = H, Me lub PhCH2 ) ". Syntezy nieorganiczne . 28 : 148–149. doi : 10.1002/9780470132593.ch39 . ISBN 9780470132593 .
- ^ Kubas, GJ; van der Sluys, LS (1990). „TrikarbonyloTris (nitryl) Kompleksy Cr, Mo i W”. Syntezy nieorganiczne . Syntezy nieorganiczne. Tom. 28. s. 29–33. doi : 10.1002/9780470132593.ch6 . ISBN 9780470132593 .
