Chlorek wolframu(IV).
|
|
| Nazwy | |
|---|---|
| Inne nazwy czterochlorek wolframu
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.157.353 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| KL 4 W | |
| Masa cząsteczkowa | 325,65 g·mol -1 |
| Wygląd | czarne ciało stałe |
| Gęstość | 4,62 g·cm -3 |
| Temperatura topnienia | 450 ° C (842 ° F; 723 K) |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H302 , H314 | |
| P260 , P264 , P270 , P280 , P301 + P312 , P301+P330+P331 , P303+P361+P353 , P304 +P340 , P305+P351+P338 , P310 , P321 , P330 , P363 , P405 , P501 | |
| Związki pokrewne | |
|
Inne aniony
|
Fluorek wolframu(IV). |
|
Związki pokrewne
|
Chlorek wolframu(V) Heksachlorek wolframu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Chlorek wolframu(IV) jest związkiem nieorganicznym o wzorze WCl 4 . Jest to diamagnetyczne czarne ciało stałe. Związek jest przedmiotem zainteresowania badań jako jeden z nielicznych binarnych chlorków wolframu .
Struktura i przygotowanie
WCl 4 jest zwykle przygotowywany przez redukcję heksachlorku wolframu . Zgłoszono wiele reduktorów, w tym czerwony fosfor, heksakarbonyl wolframu , gal, cynę i antymon. Ten ostatni jest uważany za optymalny:
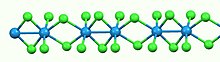
Podobnie jak większość binarnych halogenków metali, WCl 4 jest polimerem. Składa się z liniowych łańcuchów atomów wolframu, każdy w oktaedrycznej . Z sześciu ligandów chlorkowych przyłączonych do każdego centrum W cztery są ligandami mostkowymi . Separacje WW są naprzemiennie wiążące (2,688 Å) i niewiążące (3,787 Å).
Reakcje
Redukcja chlorku wolframu (IV) sodem daje pochodną heptachlorku diwolframu (III):
- 2 WCl 4 + 5 thf + 2 Na → [Na(thf) 3 ][W 2Cl 7 (thf) 2 ] + NaCl
- Bibliografia _ Kolesniczenko, Władimir; Messerle, Louis (2014). „Krystaliczne i amorficzne formy tetrachlorku wolframu”. Syntezy nieorganiczne: tom 36 . Syntezy nieorganiczne. Tom. 36. s. 30–34. doi : 10.1002/9781118744994.ch6 . ISBN 9781118744994 .
- ^ Broderick, Erin M.; Browne, Samuel C.; Johnson, Marc JA (2014). Dimolibden i Ditungsten Hexa (Alkoksylany) . Syntezy nieorganiczne. Tom. 36. s. 95–102. doi : 10.1002/9781118744994.ch18 . ISBN 9781118744994 .
