Czterochlorek molibdenu
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Czterochlorek molibdenu
|
|
| Inne nazwy Chlorek molibdenu(IV).
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.033.039 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| KL 4 Pon | |
| Masa cząsteczkowa | 237,752 g/mol |
| Wygląd | czarne ciało stałe |
| Temperatura topnienia | 552 ° C (1026 ° F; 825 K) |
| Rozkłada się | |
| Zagrożenia | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | Nie palne |
| Związki pokrewne | |
|
Związki pokrewne
|
Chlorek molibdenu(II) Chlorek molibdenu(III) Chlorek molibdenu(V). |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Czterochlorek molibdenu jest związkiem nieorganicznym o wzorze empirycznym MoCl 4 . Materiał istnieje jako dwa polimorfy , oba są ciemnymi paramagnetycznymi ciałami stałymi. Związki te są głównie interesujące jako prekursory innych kompleksów molibdenu.
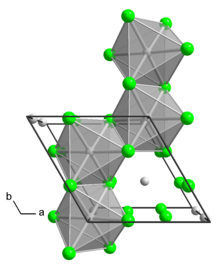
Struktura
Polimorf α jest polimerem. Polimorf β jest heksamerem. W obu odmianach polimorficznych centrum Mo jest oktaedryczne z dwoma końcowymi ligandami chlorkowymi i czterema podwójnie mostkującymi ligandami. MoCl4L2 podwójnych , znanych jest wiele adduktów o wzorze , gdzie L oznacza zasadę Lewisa .
Przygotowanie
α-Tetrachlorek molibdenu można wytworzyć przez odchlorowanie pięciochlorku molibdenu przy użyciu tetrachloroetanu :
- 2 MoCl 5 + C 2 Cl 4 → 2 MoCl 4 + C 2 Cl 6
Ogrzewanie tetrachlorku α-molibdenu w szczelnie zamkniętym pojemniku w obecności pentachlorku molibdenu indukuje konwersję do polimorfu β.
Reakcje
Po podgrzaniu w otwartym pojemniku tetrachlorek molibdenu wydziela chlor, dając trichlorek molibdenu ;
- 2 MoCl 4 → 2 MoCl 3 + Cl 2
Addukt kompleksu acetonitrylu można wytworzyć przez redukcję pentachlorku acetonitrylem:
- 2 MoCl 5 + 5 CH 3CN → 2 MoCl 4 (CH 3 CN) 2 + ClCH 2CN + HCl
Ligandy MeCN można wymieniać na inne ligandy:
- MoCl 4 (CH 3 CN) 2 + 2 THF → MoCl 4 (THF) 2 + 2 CH 3 CN
Pentachlorek można zredukować do kompleksu eterowego MoCl 4 (Et 2 O) 2 stosując sproszkowaną cynę. Jest to beżowe, paramagnetyczne ciało stałe.
- ^ Ulrich Müller (1981). „Heksameryczny tetrachlorek molibdenu”. Angewandte Chemie International Edition w języku angielskim . 20 (8): 692. doi : 10.1002/anie.198106921 .
- ; ^ abc McCann III, EL Brązowy, TM (1970). „Chlorek molibdenu (IV)” . Syntezy nieorganiczne . Syntezy nieorganiczne. Tom. 12. str. 181. doi : 10.1002/9780470132432.ch31 . ISBN 9780470132432 .
- ^ Broderick, Erin M.; Browne, Samuel C.; Johnson, Marc JA (2014). „Dimolibden i Ditungsten Hexa (alkoholany)”. Syntezy nieorganiczne: tom 36 . Syntezy nieorganiczne. Tom. 36. s. 95–102. doi : 10.1002/9781118744994.ch18 . ISBN 9781118744994 .
- ^ Dilworth, Jonathan R.; Richards, Raymond L. (1990). „Synteza kompleksów molibdenu i azotu wolframu”. Syntezy nieorganiczne . Syntezy nieorganiczne. Tom. 28. str. 33. doi : 10.1002/9780470132593.ch7 . ISBN 9780470132593 .
- ^ Maria, Sebastien; Poli, Rinaldo (2014). „Eterowe kompleksy chlorków molibdenu (III) i molibdenu (IV)”. Syntezy nieorganiczne: tom 36 . Syntezy nieorganiczne. Tom. 36. s. 15–18. doi : 10.1002/9781118744994.ch03 . ISBN 9781118744994 .
