Chlorek tantalu(V).
|
|
| Nazwy | |
|---|---|
|
nazwy IUPAC
Chlorek tantalu(V) Pentachlorek tantalu |
|
| Identyfikatory | |
|
|
|
Model 3D ( JSmol )
|
|
| Karta informacyjna ECHA | 100.028.869 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| TaCI 5 | |
| Masa cząsteczkowa | 358,213 g/mol |
| Wygląd | białe jednoskośne kryształy |
| Gęstość | 3,68 g/cm 3 |
| Temperatura topnienia | 216 ° C (421 ° F; 489 K) |
| Temperatura wrzenia | 239,4 ° C (462,9 ° F; 512,5 K) (rozkłada się) |
| reaguje | |
| Rozpuszczalność | chloroform , CCl 4 |
| +140,0 × 10-6 cm3 / mol _ | |
| Struktura | |
| Jednoskośny , mS72 | |
| C2/m, nr 12 | |
| Termochemia | |
|
Standardowa entropia molowa ( S ⦵ 298 ) |
221,75 JK -1 mol -1 |
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
-858,98 kJ/mol |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H302 , H314 | |
| P280 , P305+P351+P338 , P310 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | Nie palne |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
1900 mg/kg (doustnie, szczur) |
| Karta charakterystyki (SDS) | Karta charakterystyki zewnętrznej |
| Związki pokrewne | |
|
Inne aniony
|
Fluorek tantalu(V) Bromek tantalu(V) Jodek tantalu(V). |
|
Inne kationy
|
Chlorek wanadu(IV) Chlorek niobu(V). |
|
Związki pokrewne
|
Chlorek tantalu(III) , Chlorek tantalu(IV). |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Chlorek tantalu(V) , znany również jako pentachlorek tantalu , jest związkiem nieorganicznym o wzorze TaCl 5 . Ma postać białego proszku i jest powszechnie stosowany jako materiał wyjściowy w tantalu . Łatwo hydrolizuje, tworząc tlenochlorek tantalu(V) (TaOCl 3 ) i ostatecznie pięciotlenek tantalu (Ta 2 O 5 ); wymaga to syntezy i obróbki w warunkach bezwodnych , przy użyciu techniki bezpowietrzne .
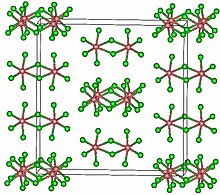
Struktura
TaCl 5 krystalizuje w jednoskośnej grupie przestrzennej C 2/ m . Dziesięć atomów chloru definiuje parę ośmiościanów, które mają wspólną krawędź. Atomy tantalu zajmują środki ośmiościanów i są połączone dwoma ligandami mostkowymi chloru . Struktura dimeryczna jest zachowana w niekompleksujących rozpuszczalnikach oraz w dużym stopniu w stanie stopionym. Jednak w stanie pary TaCl 5 jest monomerem . Ten monomer przyjmuje trygonalną strukturę bipiramidalną , taką jak PCl 5 .
Właściwości fizyczne
Rozpuszczalność pięciochlorku tantalu nieznacznie wzrasta dla następujących serii węglowodorów aromatycznych :
Znajduje to odzwierciedlenie w pogłębieniu barwy roztworów od bladożółtej do pomarańczowej. Pentachlorek tantalu jest mniej rozpuszczalny w cykloheksanie i tetrachlorku węgla niż w węglowodorach aromatycznych. Wiadomo również, że takie roztwory pięciochlorku tantalu są słabymi przewodnikami elektryczności, co wskazuje na niewielką jonizację. TaCl 5 oczyszcza się przez sublimację , otrzymując białe igły.
Synteza
Pentachlorek tantalu można otrzymać w reakcji sproszkowanego tantalu metalicznego z gazowym chlorem w temperaturze od 170 do 250 ° C. Tę reakcję można również przeprowadzić stosując HCl w temperaturze 400°C.
- 2 Ta + 5 Cl 2 → 2 TaCl 5
- 2 Ta + 10 HCl → 2 TaCl 5 + 5 H 2
Można go również wytworzyć w reakcji pięciotlenku tantalu i chlorku tionylu w temperaturze 240 ° C
- Ta 2 O 5 + 5 SOCl 2 → 2 TaCl 5 + 5 SO 2
Pentachlorek tantalu jest dostępny w handlu, jednak próbki mogą być zanieczyszczone tlenochlorkiem tantalu(V) ( TaOCl 3 ), powstałym w wyniku hydrolizy.
Reakcje
TaCl 5 jest elektrofilowy i zachowuje się jak katalizator Friedla-Craftsa , podobnie jak AlCl 3 . Tworzy addukty z różnymi zasadami Lewisa .
Proste addukty
TaCl 5 tworzy trwałe kompleksy z eterami :
- TaCl 5 + R 2 O → TaCl 5 (OR 2 ) (R = Me, Et)
TaCl 5 reaguje również z pięciochlorkiem fosforu i tlenochlorkiem fosforu , przy czym ten pierwszy jest donorem chlorków, a drugi służy jako ligand, wiążąc się przez tlen:
- TaCl 5 + PCl 5 → [ PCl
+ 4 ][ TaCl
- 6 ] - TaCl 5 + OPCl 3 → [TaCl 5 (OPCl 3 )]
Pentachlorek tantalu reaguje z aminami trzeciorzędowymi , dając krystaliczne addukty.
- TaCl 5 + 2 R 3 N → [TaCl 5 (NR 3 )]
Reakcje wypierania chlorków
Pentachlorek tantalu reaguje w temperaturze pokojowej z nadmiarem tlenku trifenylofosfiny, dając tlenochlorki:
- TaCl 5 + 3 OPPh 3 → [TaOCl 3 (OPPh 3 )] x ...
Po przypuszczalnym początkowym utworzeniu adduktów między TaCl 5 a związkami hydroksylowymi, takimi jak alkohole , fenole i kwasy karboksylowe, następuje natychmiast eliminacja chlorowodoru i utworzenie wiązań Ta–O:
- TaCl 5 + 3 HOEt → TaCl 2 (OEt) 3 + 3 HCl
W obecności amoniaku jako akceptora HCl , wszystkie pięć ligandów chlorkowych jest wypieranych z utworzeniem Ta(OEt) 5 . Podobnie TaCl 5 reaguje z metanolanem litu w bezwodnym metanolu , tworząc pokrewne pochodne metoksy:
- TaCl 5 + 4 LiOMe → Ta (OMe) 4 Cl + 4 LiCl
Amoniak wyprze większość ligandów chlorkowych z TaCl 5 , tworząc klaster. Chlorek jest wypierany wolniej przez aminy pierwszorzędowe lub drugorzędowe , ale zastąpienie wszystkich pięciu centrów chlorkowych grupami amidowymi osiągnięto dzięki zastosowaniu dialkiloamidów litu, co ilustruje synteza pentakis (dimetyloamido) tantalu :
- TaCl 5 + 5 LiNMe 2 → Ta(NMe 2 ) 5
Z alkoholami pentachlorek reaguje dając alkoholany . Jak pokazano w przypadku wytwarzania etanolanu tantalu (V) , takie reakcje często prowadzi się w obecności zasady:
- 10 EtOH + Ta 2 Cl 10 + 10 NH 3 → Ta 2 (OEt) 10 + 10 NH 4 Cl
Pentachlorek tantalu jest redukowany przez heterocykle azotu, takie jak pirydyna .
Zmniejszenie
Redukcja chlorku tantalu(V) daje klastry anionowe i obojętne, w tym [Ta 6 Cl 18 ] 4− i [Ta 6 Cl 14 ](H 2 O) 4 .
Dalsza lektura
- Ozin, Georgia; Walton, RA (1970). „Widma i struktury wibracyjne kompleksów 1:1 niobu i tantalu, pentachlorków i pentabromku tantalu z aceto-, perdeuterioaceto- i propionitrylami w stanach stałych i roztworach oraz analiza wibracyjna gatunków MX 5 , NC · CY 3 ( Y = H lub D)”. J. Chem. soc. Odp . : 2236–2239. doi : 10.1039/j19700002236 .
- Bullock, JI; Parrett, FW; Taylor, NJ (1973). „Niektóre kompleksy halogenek metalu, halogenek fosforu i halogenek alkilu. Część II. Reakcje z pięciochlorkami niobu i tantalu oraz heksachlorkiem wolframu”. J. Chem. Soc., Dalton Trans. (5): 522–524. doi : 10.1039/DT9730000522 .
- Đorđević, C.; Katović, V. (1970). „Kompleksy koordynacyjne niobu i tantalu. Część VIII. Kompleksy niobu (IV), niobu (V) i tantalu (V) z mieszanymi ligandami okso, halogenowymi, alkoksylowymi i 2,2'-bipirydylowymi”. J. Chem. soc. Odp . : 3382–3386. doi : 10.1039/j19700003382 .
- Cowley, A.; Fairbrother, F.; Scott, N. (1958). „Halogenki niobu (kolumbu) i tantalu. Część V. Kompleksy eteru dietylowego pentachlorków i pentabromków; rozpuszczalność pięciojodku tantalu w eterze”. J. Chem. soc. : 3133–3137. doi : 10.1039/JR9580003133 .

