Chlorek ceru(III).

|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
nazwy IUPAC
Chlorek ceru(III) Trichlorek ceru |
|||
| Inne nazwy Chlorek cerawy
|
|||
| Identyfikatory | |||
|
|||
|
Model 3D ( JSmol )
|
|||
| CHEBI | |||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.029.298 | ||
| Numer WE |
|
||
| 1828 | |||
|
Identyfikator klienta PubChem
|
|||
| UNII |
|
||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| CeCl 3 | |||
| Masa cząsteczkowa |
246,48 g/mol (bezwodny) 372,58 g/mol (heptahydrat) |
||
| Wygląd | drobny biały proszek | ||
| Gęstość | 3,97 g/cm 3 | ||
| Temperatura topnienia |
817 ° C (1503 ° F; 1090 K) (bezwodny) 90 ° C (heptahydrat, rozkłada się) |
||
| Temperatura wrzenia | 1727 ° C (3141 ° F; 2000 K) | ||
| 100 g/100 ml | |||
| Rozpuszczalność | rozpuszczalny w alkoholu | ||
| +2490,0· 10-6 cm3 / mol | |||
| Struktura | |||
| sześciokątny ( typu UCl 3 ), hP8 | |||
| P6 3 /m, nr 176 | |||
|
Trójkątny pryzmatyczny trygonalny (dziewięć współrzędnych) |
|||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
  
|
|||
| Niebezpieczeństwo | |||
| H315 , H318 , H319 , H335 , H410 | |||
| P261 , P264 , P271 , P273 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P332+P313 , P337+P313 , P362 , P391 , P4 03 + P233 , P405 , P501 | |||
| Punkt zapłonu | Nie palne | ||
| Związki pokrewne | |||
|
Inne aniony
|
Tlenek ceru(III) Fluorek ceru(III) Bromek ceru(III) Jodek ceru(III) |
||
|
Inne kationy
|
Chlorek lantanu(III) Chlorek prazeodymu(III). |
||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Chlorek ceru(III) (CeCl 3 ), znany również jako chlorek ceru lub trichlorek ceru, jest związkiem ceru i chloru . Jest to biała higroskopijna sól; szybko wchłania wodę w kontakcie z wilgotnym powietrzem, tworząc hydrat , który wydaje się mieć zmienny skład, chociaż znany jest heptahydrat CeCl3 ·7H2O . Jest dobrze rozpuszczalny w wodzie i (gdy jest bezwodny) jest rozpuszczalny w etanolu i acetonie .
Przygotowanie bezwodnego CeCl 3
Proste szybkie ogrzewanie samego hydratu może powodować hydrolizę w niewielkich ilościach .
Użyteczną postać bezwodnego CeCl 3 można otrzymać, jeśli zadba się o stopniowe ogrzewanie heptahydratu do 140 ° C (284 ° F) przez wiele godzin pod próżnią. Może on zawierać, ale nie musi, trochę CeOCl z hydrolizy , ale nadaje się do stosowania z litoorganicznymi i odczynnikami Grignarda . Czysty bezwodny CeCl 3 można wytworzyć przez odwodnienie hydratu przez powolne ogrzewanie do 400 ° C (752 ° F) z 4–6 równoważnikami chlorku amonu pod wysoką próżnią lub przez ogrzewanie z nadmiarem chlorku tionylu przez trzy godziny. Bezwodny halogenek można alternatywnie wytworzyć z metalicznego ceru i chlorowodoru . Zwykle jest oczyszczany przez sublimację w wysokiej temperaturze pod wysoką próżnią.
Używa
Chlorek ceru (III) może być użyty jako punkt wyjścia do przygotowania innych soli ceru , takich jak trifluorometanosulfonian ceru (III) z kwasem Lewisa , używany do acylowania Friedela-Craftsa . Sam jest również stosowany jako kwas Lewisa, na przykład jako katalizator w alkilowania Friedela-Craftsa .
Redukcja Luche alfa, beta-nienasyconych związków karbonylowych stała się popularną metodą w syntezie organicznej , gdzie CeCl 3 ·7H 2 O stosuje się w połączeniu z borowodorkiem sodu . Na przykład karwon daje tylko alkohol allilowy 1 i nie zawiera alkoholu nasyconego 2 . Bez CeCl3 powstaje mieszanina 1 i 2 .
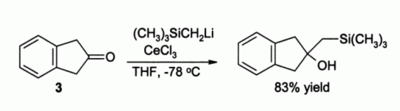
Innym ważnym zastosowaniem w syntezie organicznej jest alkilowanie ketonów , które w przeciwnym razie utworzyłyby enolany , gdyby zastosowano proste odczynniki litoorganiczne . Na przykład oczekuje się , że związek 3 po prostu utworzy enolan bez obecności CeCl3 , ale w obecności CeCl3 zachodzi gładkie alkilowanie:
Podaje się, że odczynniki litoorganiczne działają w tej reakcji skuteczniej niż odczynniki Grignarda .
Dalsza lektura
- CRC Handbook of Chemistry and Physics (wydanie 58), CRC Press, West Palm Beach, Floryda, 1977.
- Anwander, R. (1999). Kobayashi, S. (red.). Lantanowce: chemia i zastosowanie w syntezie organicznej . Berlin: Springer-Verlag. s. 10 –12. ISBN 9783540645269 .