Chlorek wanadu(III).
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
nazwy IUPAC
Chlorek wanadu(III) Trichlorek wanadu |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| ChemSpider | |||
| Karta informacyjna ECHA | 100.028.859 | ||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS |
|
||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| VC 3 | |||
| Masa cząsteczkowa | 157,30 g/mol | ||
| Wygląd |
fioletowe kryształy paramagnetyczne |
||
| Gęstość | 3,0 g/cm3 ( 20°C) | ||
| Temperatura topnienia | > 300 ° C (572 ° F; 573 K) (rozkłada się) | ||
| rozpuszczalny | |||
| +3030,0·10-6 cm 3 / mol | |||
| Struktura | |||
| Trygonalny , hR24 | |||
| R-3, nr 148 | |||
| Zagrożenia | |||
| Oznakowanie GHS : | |||
 
|
|||
| Niebezpieczeństwo | |||
| H302 , H314 | |||
| P280 , P305 , P310 , P338 , P351 | |||
| Punkt zapłonu | Nie palne | ||
| Karta charakterystyki (SDS) | Chlorek wanadu(III). | ||
| Związki pokrewne | |||
|
Inne aniony
|
trifluorek wanadu , tribromek wanadu | ||
|
Inne kationy
|
trichlorek tytanu , chlorek chromu(III) , trichlorek niobu , trichlorek tantalu | ||
|
Związki pokrewne
|
dichlorek wanadu , tetrachlorek wanadu | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
Trichlorek wanadu jest związkiem nieorganicznym o wzorze VCl 3 . Ta purpurowa sól jest powszechnym prekursorem innych kompleksów wanadu (III).
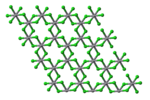
Struktura
VCl 3 ma wspólną strukturę BiI 3 , motyw zawierający heksagonalnie upakowaną strukturę chlorkową z jonami wanadu zajmującymi oktaedryczne otwory. VBr 3 i VI 3 przyjmują tę samą strukturę, ale VF 3 ma strukturę bardziej zbliżoną do ReO 3 . VCl 3 jest paramagnetykiem i ma dwa niesparowane elektrony.
Przygotowanie i reakcje
VCl 3 jest przygotowywany przez ogrzewanie VCl 4 w temperaturze 160-170 °C pod przepływającym strumieniem gazu obojętnego, który usuwa Cl 2 . Jasnoczerwona ciecz zamienia się w fioletową substancję stałą.
Ogrzewanie VCl 3 rozkłada się wraz z ulatnianiem się VCl 4 , pozostawiając VCl 2 . Po ogrzaniu pod H2 w temperaturze 675°C (ale poniżej 700°C), VCl3 redukuje się do zielonkawego VCl2 .
- 2 VCI 3 + H 2 → 2 VCI 2 + 2 HCl
Komproporcjonowanie trichlorku wanadu i tlenków wanadu (V) daje tlenodichlorek wanadu :
- V 2 O 5 + VOCl 3 + 3 VCl 3 → 6 VOCl 2
Trichlorek wanadu katalizuje reakcję sprzęgania pinakolu benzaldehydu (PhCHO) z 1,2-difenylo-1,2-etanodiolem przez różne metale redukujące, takie jak cynk:
- Zn + 2 H2O + 2 PhCHO → (PhCH(OH)) 2 + Zn(OH) 2
Kompleksy
VCl 3 tworzy kolorowe addukty i pochodne z szeroką gamą ligandów. VCl 3 rozpuszcza się w wodzie, dając heksahydrat , ale formuła jest zwodnicza. Sól jest opisana wzorem [VCl2 ( H2O ) 4 ] Cl . 2H 2 O. Innymi słowy, dwie cząsteczki wody nie są związane z wanadem, którego struktura przypomina odpowiednią pochodną Fe(III). Usunięcie dwóch związanych ligandów chlorkowych z [ VCl2 ( H2O ) 4 ] + w roztworze wodnym daje zielony jon [V(H 2 O) 6 ] 3+ .
Z tetrahydrofuranem VCl 3 tworzy czerwono-różowy kompleks VCl 3 (THF) 3 . Chlorek wanadu(III) reaguje z acetonitrylem dając zielony addukt VCl 3 (MeCN) 3 . Po potraktowaniu KCN, VCl 3 przekształca się w [V(CN) 7 ] 4− (wczesne metale zwykle przyjmują liczby koordynacyjne większe niż 6 ze zwartymi ligandami). Dodatkowo, większe metale mogą tworzyć kompleksy z ligandami o większej objętości. Ten aspekt ilustruje wyodrębnienie VCl3 ( NMe 3 ) 2 , zawierający dwa duże ligandy NMe3 .
Pochodne metaloorganiczne
Chlorek wanadu(III) jako jego kompleks thf jest prekursorem V( mezytylu ) 3 .
- VCl 3 (THF) 3 + 3 LiC 6 H 2 -2,4,6-Me 3 → V(C 6 H 2 -2,4,6-Me 3 ) 3 (THF) + 3 LiCl