Kwas sulfenowy
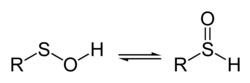
W chemii kwas sulfenowy jest związkiem siarkoorganicznym i oksokwasem o ogólnym wzorze R-S-OH . Jest pierwszym członkiem rodziny oksokwasów siarkoorganicznych, do których należą odpowiednio R-S(=O) ) kwasy sulfinowe ( RS-S(=O) 2OH 2H i kwasy sulfonowe ( ). Podstawowym członkiem serii kwasu sulfenowego z R = H jest tionadtlenek wodoru .
Nieruchomości
W przeciwieństwie do kwasów sulfinowych i sulfonowych, proste kwasy sulfenowe, takie jak kwas metanosulfenowy, CH3SOH , są wysoce reaktywne i nie można ich wydzielić w roztworze. W fazie gazowej czas życia kwasu metanosulfenowego wynosi około jednej minuty. Strukturę gazową kwasu metanosulfenowego stwierdzono za pomocą spektroskopii mikrofalowej ( spektroskopia rotacyjna ) jako CH 3 –S–O–H. Kwasy sulfenowe można stabilizować za pomocą efektów sterycznych, które zapobiegają kondensacji kwasu sulfenowego ze sobą w celu utworzenia tiosulfinianów , RS (O) SR, takich jak allicyna z czosnku . Dzięki zastosowaniu krystalografii rentgenowskiej wykazano, że struktura takich stabilizowanych kwasów sulfenowych to R – S – O – H. Stwierdzono, że stabilny kwas sulfenowy z zawadą przestrzenną, kwas 1-tryptycenosulfenowy, ma p Ka 12,5 i energię dysocjacji wiązania O – H (bde) 71,9 ± 0,3 kcal / mol, co można porównać z ap K a ≥14 i O – H BDE ~ 88 kcal/mol dla (walencyjnych) izoelektronowych wodoronadtlenków , R O O H .
Powstanie i występowanie
Peroksiredoksyny
Peroksiredoksyny to wszechobecne i obfite enzymy , które odtruwają nadtlenki. Działają poprzez konwersję reszty cysteiny do kwasu sulfenowego. Kwas sulfenowy następnie przekształca się w dwusiarczek w reakcji z inną resztą cysteiny.
Czosnek i cebula
Kwasy sulfenowe powstają w wyniku enzymatycznego rozkładu alliiny i związków pokrewnych po uszkodzeniu tkanek czosnku , cebuli i innych roślin z rodzaju Allium . Kwas 1-propenosulfenowy, powstający podczas krojenia cebuli, jest szybko przekształcany przez drugi enzym, syntazę czynnika łzawiącego, dając syn -propanethial- S -tlenek . Uważa się , że kwas 2-propenosulfenowy, utworzony z allicyny , jest odpowiedzialny za silne działanie przeciwutleniające czosnku. Spektrometria mas ze źródłem jonów DART zostały użyte do zidentyfikowania 2-propenosulfenu powstającego podczas krojenia lub miażdżenia czosnku oraz do wykazania, że ten kwas sulfenowy ma czas życia krótszy niż jedna sekunda. Uważa się , że aktywność farmakologiczna niektórych leków, takich jak omeprazol , esomeprazol , tiklopidyna , klopidogrel i prasugrel , obejmuje półprodukty kwasu sulfenowego. Sugeruje się, że utlenianie cysteiny w białku do odpowiednich białek kwasów sulfenowych jest ważne w reakcjach redoks , w których pośredniczy transdukcja sygnału .
Kwas sulfenowy jest częścią szeregu reakcji chemicznych zachodzących podczas krojenia cebuli. Gruczoły łzowe są podrażnione przez produkt końcowy reakcji, syn-propanethial-S-tlenek , powodując łzy.
Chemia organiczna i nieorganiczna
Sulfotlenki mogą podlegać eliminacji termicznej za pomocą mechanizmu E i z wytworzeniem alkenów winylowych i kwasów sulfenowych:
Reagujące w ten sposób związki stosowane są jako stabilizatory polimerów , gdzie chronią przed długotrwałym starzeniem cieplnym, popularne są konstrukcje na bazie estrów tiodipropionianowych.
Ligandy na bazie siarczanów znajdują się w miejscu aktywnym hydrataz nitrylowych . Grupa S=O jest proponowana jako nukleofil atakujący nitryl.
Inne związki sulfenylowe
Przedrostek sulfenyl w nomenklaturze organicznej oznacza grupę RS (R ≠ H). Jednym z przykładów jest chlorek metanosulfenylu , CH3SCl .
Estry siarczanowe mają wzór RSOR ′. Powstają w wyniku reakcji chlorków sulfenylu z alkoholami. Estry sulfonianowe są produktami pośrednimi w przegrupowaniu Mislowa-Evansa sulfotlenków allilu. Sulfenamidy mają wzór RSNR′ 2 .


