Supresor wyciszający RNA p19
| Supresor wyciszający RNA p19 | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Identyfikatory | |||||||||
| Symbol | Tombus_p19 | ||||||||
| Pfam | PF03220 | ||||||||
| InterPro | IPR004905 | ||||||||
| |||||||||
Supresor wyciszający RNA p19 (znany również jako białko rdzeniowe P19 wirusa Tombus i modulator nasilenia objawów o masie 19 kDa ) jest białkiem ulegającym ekspresji z genu ORF4 w genomie wirusów tombus . Wirusy te są wirusami jednoniciowego RNA o dodatniej polaryzacji , które infekują komórki roślinne , w których wyciszanie RNA tworzy powszechny i solidny system obrony przeciwwirusowej. Białko p19 służy jako strategia obrony, specyficznie wiążąc dwuniciowe RNA o długości od 19 do 21 nukleotydów , które działają jako mały interferujący RNA (siRNA) w systemie wyciszania RNA. Poprzez sekwestrację siRNA, p19 hamuje wyciszanie RNA i sprzyja proliferacji wirusa. Białko p19 uważane jest za istotny czynnik zjadliwości i składnik ewolucyjnego wyścigu zbrojeń pomiędzy roślinami a ich patogenami .
Struktura
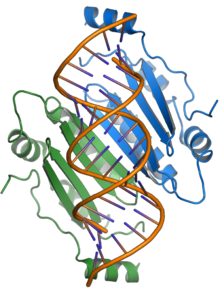
Nazwa białka p19 wzięła się od jego wielkości wynoszącej około 19 kilodaltonów . Tworzy funkcjonalny homodimer . Dostępne są struktury krystaliczne białek p19 z wirusa karłowatości krzaczastej pomidora i wirusa pierścieniowej plamistości włoskiej goździka ; białko składa się z nowego fałdu białkowego i stanowi przykład nieznanego wcześniej mechanizmu wiązania RNA z wykorzystaniem powierzchni wiążącej utworzonej przez arkusz beta i otoczonej helisami alfa oddziaływać z dwuniciowym RNA o długości około 21 nukleotydów w sposób niespecyficzny dla sekwencji.
Funkcjonować
Białko p19 wiąże się z dwuniciowym RNA, które działa jako krótki interferujący RNA (siRNA) i specjalizuje się w 21-nukleotydowym produkcie enzymu DCL4 (należącego do rodziny enzymów roślinnych homologii z Dicer ). Wiążąc się z siRNA, p19 sekwestruje te gatunki i uniemożliwia im interakcję z kompleksem wyciszającym indukowanym RNA (RISC), kompleksem białkowym , który pośredniczy w przeciwwirusowym mechanizmie wyciszania RNA w komórce.
Białko p19 jest również zdolne do wiązania się z cząsteczkami mikroRNA , które są endogenne dla komórki gospodarza, jak również z siRNA, które ostatecznie pochodzą z własnego genomu wirusa. Warto zauważyć, że wyjątkiem od tego wzorca jest nieefektywność p19 w interakcji z mikroRNA miR-168, regulatorowym niekodującym RNA , który tłumi ekspresję argonauta -1 (AGO1). Białko AGO1 jest wymagane do wyciszania RNA, zatem selektywne oszczędzanie jego represora przed ogólną sekwestracją miRNA przez p19 powoduje zmniejszenie poziomu komórkowego AGO1 i stanowi dodatkowy mechanizm, dzięki któremu p19 hamuje wyciszanie. Obydwa mechanizmy są od siebie niezależne i mogą zostać selektywnie zniesione przez mutacje .
Ewolucja
Gen kodujący białko p19 jest przykładem genu nadrukowanego , czyli układu genomowego powszechnego w wirusach, w którym wiele genów jest kodowanych przez tę samą część genomu odczytywaną w alternatywnych ramkach odczytu . Otwarta ramka odczytu ORF4, która koduje p19, jest całkowicie zawarta w otwartej ramce odczytu innego genu, oznaczonego jako ORF3 i kodującego białko ruchu p22. Obydwa geny i ich względne pozycje są zachowane w rodzinie wirusów tombus. Uważa się, że P19 powstał de novo w tej linii.
Sekwestracja dsRNA to powszechna wirusowa strategia obrony przed wyciszaniem RNA, która rozwinęła się w formie ewolucyjnego wyścigu zbrojeń pomiędzy wirusem a gospodarzem. Białko p19 nie jest wyjątkowe w tej roli; w przykładzie ewolucji zbieżnej wydaje się, że strategia ta ewoluowała co najmniej trzykrotnie w różnych liniach wirusowych przy użyciu białek o odrębnych strukturach i fizycznych sposobach wiązania RNA.
Historia
Wirus krzaczastej karłowatości pomidora , będący gatunkiem należącym do rodziny wirusów tombus , jest od dawna stosowanym systemem modelowym do badania wirusów roślinnych . Otwartą ramkę odczytu kodującą p19 odkryto pierwotnie pod koniec lat 80. XX wieku, kiedy sekwencjonowano genom wirusa; następnie wykazano, że przewidywane białko rzeczywiście ulegało ekspresji z genu, chociaż początkowo niedoceniano jego roli w promowaniu zjadliwości i zakaźności. Po wyjaśnieniu jego roli jako supresora wyciszania RNA, p19 zastosowano również jako narzędzie w zakresu biologii molekularnej dotyczące wyciszania RNA, interferencji RNA i procesów pokrewnych.