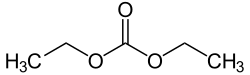
Węglan dietylu
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Węglan dietylu |
|
| Inne nazwy eter węglowy; węglan etylu, di-; Eufin
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.003.011 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| Numer RTECS |
|
| UNII | |
| Numer ONZ | 2366 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C5H10O3 _ _ _ _ _ | |
| Masa cząsteczkowa | 118,132 g·mol -1 |
| Wygląd | Bezbarwna ciecz |
| Gęstość | 0,975 g/ cm3 |
| Temperatura topnienia | -43 ° C (-45 ° F; 230 K) |
| Temperatura wrzenia | 126 do 128 ° C (259 do 262 ° F; 399 do 401 K) |
| Nierozpuszczalny | |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Ostrzeżenie | |
| H226 , H315 , H319 , H335 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P280 , P302+P352 , P303+P361+P353 , P304+P340 , P305 + P351+P338 , P312 , P3 21 , P332 + P313 , P337+ P313 , P362 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |
| Punkt zapłonu | 33 ° C (91 ° F; 306 K) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Węglan dietylu (czasami w skrócie DEC ) jest estrem kwasu węglowego i etanolu o wzorze OC(OCH 2 CH 3 ) 2 . W temperaturze pokojowej (25°C) węglan dietylu jest bezbarwną cieczą o niskiej temperaturze zapłonu .
Węglan dietylu jest stosowany jako rozpuszczalnik , na przykład w zastrzykach domięśniowych erytromycyny . Może być stosowany jako składnik elektrolitów w bateriach litowych . Został zaproponowany jako dodatek do paliwa wspomagający czystsze spalanie oleju napędowego, ponieważ jego wysoka temperatura wrzenia może zmniejszyć lotność mieszanych paliw, minimalizując gromadzenie się oparów w ciepłe dni, które mogą blokować przewody paliwowe. Jako dodatek do paliw może ograniczać emisje lotnych związków organicznych, CO 2 i cząstek stałych.
Produkcja
Można go wytworzyć w reakcji fosgenu z etanolem, w wyniku której powstaje chlorowodór jako produkt uboczny. Ponieważ chloroform może reagować z tlenem, tworząc fosgen, chloroform można ustabilizować do przechowywania, dodając 1 część (masową) etanolu na 100 części (masowych) chloroformu, tak aby każdy powstający fosgen został przekształcony w węglan dietylu.
- 2 CH 3 CH 2 OH + COCl 2 → CO 3 (CH 2 CH 3 ) 2 + 2 HCl
Można go również wytworzyć przez alkoholizę mocznika etanolem. Ta reakcja wymaga heterogenicznej katalizy, która może działać zarówno jako kwas Lewisa, jak i zasada, taka jak różne tlenki metali. Reakcja przebiega poprzez tworzenie pośredniego karbaminianu etylu .
- 2 CH 3 CH 2 OH + CO(NH 2 ) 2 → CO 3 (CH 2 CH 3 ) 2 + NH 3
Można go również syntetyzować bezpośrednio z dwutlenku węgla i etanolu różnymi metodami oraz poprzez utleniające karbonylowanie tlenkiem węgla . Inną metodą jest transestryfikacja z węglanu dimetylu . Jeszcze inną metodą jest reakcja azotynu etylu i tlenku węgla, w której azotyn etylu można wytworzyć z tlenku azotu i etanolu. Ta metoda wymaga katalizatora, takiego jak pallad.
Zobacz też
- ^ „WĘGLAN DIETYLU” . Źródło 2010-02-01 .
- Bibliografia _ „Schematy fazy ciekłej / stałej węglanów binarnych do akumulatorów litowych”. Dziennik Towarzystwa Elektrochemicznego . 148 : A299-A304. doi : 10.1149/1.1353568 .
- ^ Anderson, Robert C.; Harris, Paul N.; Chen, KK (1955). „Dalsze badania toksykologiczne z ilotycyną® (erytromycyna, Lilly)” . Dziennik Amerykańskiego Stowarzyszenia Farmaceutycznego . 44 (4): 199–204. doi : 10.1002/jps.3030440404 . ISSN 1930-2304 . PMID 14367139 .
- ^ US 4382086 , Sciavolino, Frank C. & Hauske, James R., „9-Dihydro-11,12-ketalowe pochodne erytromycyny A i epi-erytromycyny A”, opublikowane 1983-05-03, wydane 1982-03-01 , przypisany do Pfizer Inc.
- ^ US 4363803 , Hauske, James R., „3”, 4”-oksyallilenoerytromycyna i oleandomycyna, skład i sposób użycia”, opublikowany 14.12.1982, wydany 01.03.1982, przydzielony firmie Pfizer Inc.
- ^ Walter, K. Naukowcy odkrywają metodę czystszych paliw kopalnych. Magazyn MR&D. 18.09.2017 - 15:16
- ^ a b c Shukla, Kartikeya; Srivastava, Vimal Chandra (2016). „Węglan dietylu: krytyczny przegląd dróg syntezy, zastosowanych katalizatorów i aspektów technicznych” . Zaliczki RSC . 6 (39): 32624–32645. Bibcode : 2016RSCAd...632624S . doi : 10.1039/c6ra02518h . Źródło 3 sierpnia 2021 r .